题目内容
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A、X与Y形成化合物时,X可以显负价,Y显正价 |
| B、最高价含氧酸的酸性:X对应的酸性弱于Y对应的 |
| C、第一电离能可能Y小于X |
| D、气态氢化物的稳定性:HmY小于HnX |
考点:原子结构与元素周期律的关系
专题:
分析:同周期自左而右元素的电负性增大,非金属性增强,但稀有气体电负性、非金属性最小.
A.电负性越大,对电子吸引力越大,化合时表现负化合价;
B.电负性越大,非金属性越强,最高价含氧酸的酸性越强;
C.第一电离能:Y可能大于X,如N>O;
D.元素非金属性越大,氢化物越稳定.
A.电负性越大,对电子吸引力越大,化合时表现负化合价;
B.电负性越大,非金属性越强,最高价含氧酸的酸性越强;
C.第一电离能:Y可能大于X,如N>O;
D.元素非金属性越大,氢化物越稳定.
解答:
解:同周期自左而右元素的电负性增大,非金属性增强,但稀有气体电负性最小;
A.电负性X>Y,则X元素对电子吸引力更强,与Y化合时X表现负价,Y表现正价,故A正确;
B.同周期元素,电负性X>Y,故非金属性X>Y,非金属性越强,最高价含氧酸的酸性越强,故B错误;
C.第一电离能:Y可能大于X,如N>O等,故C正确;
D.若X、Y均为非金属,元素的非金属性越强,其气态氢化物的稳定性越强,非金属性X>Y,则气态氢化物的稳定性:HmY小于HnX,故D正确;
故选B.
A.电负性X>Y,则X元素对电子吸引力更强,与Y化合时X表现负价,Y表现正价,故A正确;
B.同周期元素,电负性X>Y,故非金属性X>Y,非金属性越强,最高价含氧酸的酸性越强,故B错误;
C.第一电离能:Y可能大于X,如N>O等,故C正确;
D.若X、Y均为非金属,元素的非金属性越强,其气态氢化物的稳定性越强,非金属性X>Y,则气态氢化物的稳定性:HmY小于HnX,故D正确;
故选B.
点评:本题考查元素周期律,难度不大,同时考查学生运用元素周期律能力,注意第一电离能规律中的异常现象.

练习册系列答案
相关题目
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.344L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入 6mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、40mL |
| C、30 mL |
| D、15 mL |
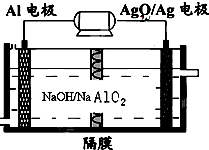 铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )
铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示.下列说法正确的是( )| A、电池负极反应式2Ag+2OH--2e-=Ag 2O+H2O |
| B、放电时电池负极附近PH减小 |
| C、电池总反应式2Al+3Ag2O+6H+=2Al3++6Ag+3H2O |
| D、电解液中Na+通过隔膜由右向左移动 |
反应aA(g)+bB(g)?cC(g)+dD(g),若v (D)=b mol?L-1?s-1,则v (B)为( )
| A、b2 mol?L-1?s-1 | ||
B、
| ||
| C、b mol?L-1?s-1 | ||
| D、db2 mol?L-1?s-1 |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A、若周期表中第七周期完全排满共有32种元素 |
| B、周期表中共有18个列,其中形成化合物种类最多的在第14列 |
| C、除过渡元素外周期表中最外层电子数相同的元素都位于同一族中 |
| D、L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
下列各组离子一定能大量共存的是( )
| A、含有大量Fe3+的溶液中:NH4+、Na+、Cl-、OH- |
| B、在强碱溶液中:Na+、K+、ClO-、CO32- |
| C、在强酸的溶液中:K+、Fe2+、Cl-、NO3- |
| D、在强碱的溶液中:K+、Na+、Ca2+、HCO3- |