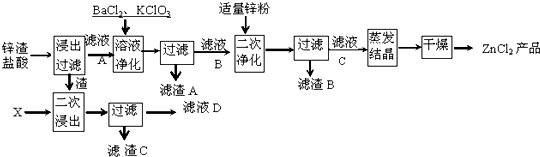
题目内容
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去).
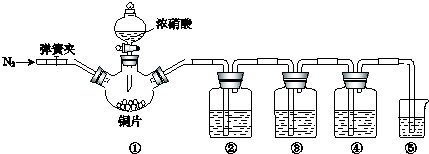
可选药品:稀硝酸、浓硝酸、浓硫酸、NaOH溶液、蒸馏水
查阅资料:A.浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.
B.氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)①中发生反应的离子方程式是 .
(2)②中发生反应的化学方程式是 .
(3)装置②~⑤中盛放的药品分别是② 、③ 、④ 、⑤ .
(4)Ⅱ的操作是 ,目的是 .
(5)该同学得出结论所依据的实验现象是 .

可选药品:稀硝酸、浓硝酸、浓硫酸、NaOH溶液、蒸馏水
查阅资料:A.浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.
B.氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2NaOH=NaNO3+NaNO2+H2O
| 实验过程 | 实验现象 |
| Ⅰ.检验装置的气密性 | \ |
| Ⅱ.… | \ |
| Ⅲ.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | ①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
(2)②中发生反应的化学方程式是
(3)装置②~⑤中盛放的药品分别是②
(4)Ⅱ的操作是
(5)该同学得出结论所依据的实验现象是
考点:性质实验方案的设计,硝酸的化学性质
专题:实验设计题
分析:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水;
(2)进入装置②中的气体为二氧化氮,二氧化氮与水反应生成硝酸与NO;
(3)①中产生大量的红棕色气体即NO2,红棕色气体在②中变为无色即反应消耗二氧化氮,所以②是蒸馏水,气体通过③后依然为无色,说明不反应,故③为稀硝酸,通过④后变为红棕色,则进入装置④的气体为NO,浓硝酸能将NO氧化成NO2,所以④为浓硝酸,由装置④出来的尾气中含有NO、NO2,NO、NO2都是有毒气体,直接排放为污染空气,所以最后用氢氧化钠吸收;
(4)装置中残存的空气能氧化NO而对实验产生干扰;
(5)根据③中液面上方为无色,④中液面上方变为红棕色判断.
(2)进入装置②中的气体为二氧化氮,二氧化氮与水反应生成硝酸与NO;
(3)①中产生大量的红棕色气体即NO2,红棕色气体在②中变为无色即反应消耗二氧化氮,所以②是蒸馏水,气体通过③后依然为无色,说明不反应,故③为稀硝酸,通过④后变为红棕色,则进入装置④的气体为NO,浓硝酸能将NO氧化成NO2,所以④为浓硝酸,由装置④出来的尾气中含有NO、NO2,NO、NO2都是有毒气体,直接排放为污染空气,所以最后用氢氧化钠吸收;
(4)装置中残存的空气能氧化NO而对实验产生干扰;
(5)根据③中液面上方为无色,④中液面上方变为红棕色判断.
解答:
解:(1)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O,反应离子方程式为Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)①中产生大量的红棕色气体即NO2,红棕色气体在②中变为无色即反应消耗二氧化氮,所以②是蒸馏水,气体通过③后依然为无色,说明不反应,故③为稀硝酸,通过④后变为红棕色,则进入装置④的气体为NO,浓硝酸能将NO氧化成NO2,所以④为浓硝酸,由装置④出来的尾气中含有NO、NO2,NO、NO2都是有毒气体,直接排放为污染空气,所以最后用氢氧化钠吸收;故答案为:蒸馏水;稀硝酸;浓硝酸;氢氧化钠溶液;
(4)由于装置中残存的空气,能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间N2赶走装置中的空气,
故答案为:打开弹簧夹,通一段时间N2,关闭弹簧夹;赶净装置中的空气(或氧气);
(5)根据③中液面上方为无色,④中液面上方变为红棕色说明一氧化氮不能被稀硝酸氧化而被浓硝酸氧化成二氧化氮;
故答案为:③中液面上方为无色,④中液面上方变为红棕色.
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)①中产生大量的红棕色气体即NO2,红棕色气体在②中变为无色即反应消耗二氧化氮,所以②是蒸馏水,气体通过③后依然为无色,说明不反应,故③为稀硝酸,通过④后变为红棕色,则进入装置④的气体为NO,浓硝酸能将NO氧化成NO2,所以④为浓硝酸,由装置④出来的尾气中含有NO、NO2,NO、NO2都是有毒气体,直接排放为污染空气,所以最后用氢氧化钠吸收;故答案为:蒸馏水;稀硝酸;浓硝酸;氢氧化钠溶液;
(4)由于装置中残存的空气,能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间N2赶走装置中的空气,
故答案为:打开弹簧夹,通一段时间N2,关闭弹簧夹;赶净装置中的空气(或氧气);
(5)根据③中液面上方为无色,④中液面上方变为红棕色说明一氧化氮不能被稀硝酸氧化而被浓硝酸氧化成二氧化氮;
故答案为:③中液面上方为无色,④中液面上方变为红棕色.
点评:本题主要考查HNO3的性质、物质验证性实验设计,利用对比的方法判断硝酸的性质,题目难度中等,是对基础知识与学生综合能力的考查,理解原理与各装置作用是解题的关键.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
对化学用语的理解影响我们的学习,下列叙述正确的是( )
| A、氯化钠溶液在电流作用下电离成氯离子和钠离子 |
| B、溶于水后电离出氢离子的化合物都是酸 |
| C、硫酸钡难溶于水但硫酸钡是强电解质 |
| D、氨气溶于水能部分电离,故氨气属于弱电解质 |
在下列反应中,水既不作氧化剂又不作还原剂的氧化还原反应是( )
| A、2Na+2H2O═2NaOH+H2↑ | ||||
B、C+H2O(g)
| ||||
| C、CaO+H2O═Ca(OH)2 | ||||
| D、Cl2+H2O═HCl+HClO |
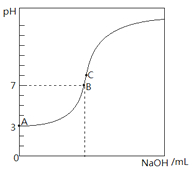 常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )
常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )| A、由图可知HA是一种弱酸,且Ka=1.0×10-5 |
| B、滴定到B点时,c(Na+)=c(A-) |
| C、当NaOH溶液的体积为10.00mL时,有c(A-)+c(OH-)=c(H+)+c(HA) |
| D、C点溶液中的离子浓度关系为:c(Na+)>c(A-) |