题目内容
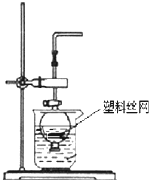 用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )
用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )| A、用块状大理石与稀硫酸反应制取CO2 |
| B、用锌粒与稀硫酸反应制取H2 |
| C、用过氧化钠与水反应制取O2 |
| D、用二氧化锰与浓盐酸反应制取Cl2 |
考点:常见气体制备原理及装置选择
专题:
分析:根据反应的速率和操控的难以程度选择药品和反应,该装置特点为:无须加热反应;当将装置中的导气管关闭后,生成的气体使装置中的气压增大,从而使固体和液体分离,使反应停止,据此解答.
解答:
解:A.用块状大理石与硫酸反应制取CO2,反应生成硫酸钙、水和二氧化碳,硫酸钙微溶,覆盖在碳酸钙表面,阻止继续反应,故A错误;
B.用锌粒与稀硫酸反应制取H2,锌可放在有空的塑料丝网上,反应进行过程中,锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑,关闭该装置中分液漏斗活塞后,装置内气压增加,可以观察到烧杯内液面上升,反应液与块状固体脱离,反应停止,故B正确;
C.用过氧化钠与水反应制取O2,过氧化钠放在有空的塑料丝网上,反应进行过程中,2Na2O2+2H2O=4NaOH+O2↑,因过氧化钠溶于水,且和水反应,关闭该装置中分液漏斗活塞后,无法将反应液与块状固体脱离,故C错误;
D.用二氧化锰与浓盐酸反应制取Cl2,MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,反应需加热,该装置无法实现,故D错误;
故选B.
B.用锌粒与稀硫酸反应制取H2,锌可放在有空的塑料丝网上,反应进行过程中,锌与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑,关闭该装置中分液漏斗活塞后,装置内气压增加,可以观察到烧杯内液面上升,反应液与块状固体脱离,反应停止,故B正确;
C.用过氧化钠与水反应制取O2,过氧化钠放在有空的塑料丝网上,反应进行过程中,2Na2O2+2H2O=4NaOH+O2↑,因过氧化钠溶于水,且和水反应,关闭该装置中分液漏斗活塞后,无法将反应液与块状固体脱离,故C错误;
D.用二氧化锰与浓盐酸反应制取Cl2,MnO2+4HCl(浓)
| ||
故选B.
点评:本题考查了实验基本操作,解答时需抓住反应的原理解答,平时注意相关知识的积累,题目难度中等.

练习册系列答案
相关题目
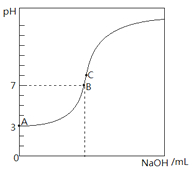 常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )
常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )| A、由图可知HA是一种弱酸,且Ka=1.0×10-5 |
| B、滴定到B点时,c(Na+)=c(A-) |
| C、当NaOH溶液的体积为10.00mL时,有c(A-)+c(OH-)=c(H+)+c(HA) |
| D、C点溶液中的离子浓度关系为:c(Na+)>c(A-) |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.344L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入 6mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、40mL |
| C、30 mL |
| D、15 mL |
根据下列三个反应,判断下列物质的氧化性由强到弱的顺序是( )
①2Fe3++2I-=2Fe2++I2
②2Fe2++C12=2Fe3++2C1-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
①2Fe3++2I-=2Fe2++I2
②2Fe2++C12=2Fe3++2C1-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
| A、Fe3+>C12>MnO4- |
| B、Fe3+>Cl2>I2 |
| C、I2>Cl2>Fe3+ |
| D、MnO4->Cl2>Fe3+ |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A、若周期表中第七周期完全排满共有32种元素 |
| B、周期表中共有18个列,其中形成化合物种类最多的在第14列 |
| C、除过渡元素外周期表中最外层电子数相同的元素都位于同一族中 |
| D、L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
 如图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物.
如图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物.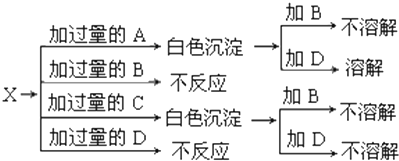 如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.
如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.