题目内容
2.高纯MnCO3是广泛用于电子行业的强磁性材料.MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解.Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图1,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2$\frac{\underline{\;电炉\;}}{\;}$MnSO4+H2O.下列措施中,目的是加快化学反应速率的是AB(填标号).
A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓) $\frac{\underline{\;电电炉\;}}{\;}$ 2NaHSO4+SO2↑+H2O.选择如图2所示部分装置与图装1置相连制备MnSO4溶液,应选择的装置有abef(填标号).
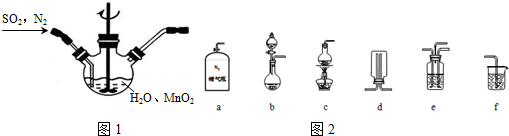
③若用空气代替N2进行实验,缺点是空气中的O2能氧化H2SO3,使SO2利用率下降.(酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;②…;③在70-80℃下烘干得到纯净干燥的MnCO3固体.
步骤②需要用到的试剂有乙醇.
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明KSP(MnCO3)<KSP(NiCO3):向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色.(已知NiCO3为难溶于水的浅绿色固体)
(4)证明H2SO4的第二步电离不完全:用pH计测量Na2SO4溶液的pH大于7.[查阅资料表明K2(H2SO4)=1.1×10-2].
分析 (1)①增大接触面积,反应速率加快,提高混合其中N2比例,二氧化硫的浓度减小;
②b装置制备二氧化硫,氮气与二氧化硫通过e装置混合,在图1装置中反应生成MnSO4,利用f进行尾气处理,防止污染空气;
③氧气能与亚硫酸反应生成硫酸;
(2)步骤②为洗涤杂质,防止氧化与溶解损失;
(3)利用MnCO3转化为NiCO3浅绿色固体设计;
(4)测定0.1mol/L的硫酸氢钠溶液的pH或Na2SO4溶液pH.
解答 解:(1)①MnO2研磨、反应时搅拌均可以增大接触面积,加快反应速率,提高混合其中N2比例,二氧化硫的浓度减小,反应速率减小,
故选:AB;
②反应不需要加热制备二氧化硫,b装置制备二氧化硫,氮气与二氧化硫通过e装置混合,在图1装置中反应生成MnSO4,利用f进行尾气处理,防止尾气中二氧化硫污染空气,
故选:abef;
③制备原理为:H2SO3+MnO2═MnSO4+H2O,若用空气代替N2进行实验,氧气能与亚硫酸反应生成硫酸,二氧化硫利用率降低,
故答案为:空气中的O2能氧化H2SO3,使SO2利用率下降;
(2)步骤②为洗涤杂质,MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,应用乙醇洗涤,可以防止被氧化,因溶解导致的损失,
故答案为:乙醇;
(3)先向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色,可证明KSP(MnCO3)<KSP(NiCO3),
故答案为:向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色;
(4)配制0.1mol/L NaHSO4溶液,测定溶液pH>1,则说明H2SO4的第二步电离不完全,或用pH计测量Na2SO4溶液的pH大于7,也可证明H2SO4的第二步电离不完全,
故答案为:配制0.1mol/L NaHSO4溶液,测定溶液pH>1,说明H2SO4的第二步电离不完全(或用pH计测量Na2SO4溶液的pH大于7).
点评 本题通过制备方案的设计,考查了反应速率影响因素、对原理与装置的分析评价、物质的分离提纯、实验方案设计等知识,题目难度中等,注意对题目信息的应用,是对学生综合能力的考查,需要学生具备扎实的基础,试题培养了学生的化学实验能力.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 乙烯与水反应制乙醇、乙醇与氧气反应制乙醛都属于加成反应 | |
| B. | 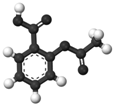 图为阿司匹林的球棍模型,其分子式是C9H8O4 | |
| C. | CH≡CH通过加聚反应可以得到结构片段为“…-CH=CH-CH=CH-…”的高分子化合物 | |
| D. | 往蛋白质溶液中加入饱和(NH4)2SO4溶液、CuSO4溶液都能产生沉淀,其原理不相同 |
| A. | 氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 水玻璃可用作木材防火剂 | |
| D. | 氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃 |
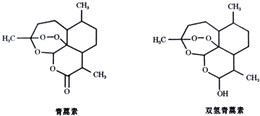
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素和双氢青蒿素不是同分异构体 | |
| C. | 青蒿素和双氢青蒿素都能发生酯化反应 | |
| D. | 青蒿素在稀硫酸催化条件下能发生水解反应 |
| A. | 常温下,1L pH=3的硫酸溶液中,SO42-离子的数目约为5×10-4NA | |
| B. | 1mol氨基(NH2)中含有电子的数目为10NA | |
| C. | 一定条件下,1molN2与3molH2充分反应,转移电子的数目可能为2NA | |
| D. | 3molNO2和H2O完全反应,被还原的NO2分子数目为1NA |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将KI和FeCl3溶液在试管中混合后,滴加KSCN溶液 | 溶液变红色 | 氧化性:Fe2+>I2 |
| B | 少量的乙烯通入pH=3的溴水中 | 溴水褪色,pH基本不变 | 两者发生的加成反应 |
| C | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液中一定无NH4+ |
| D | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| A. | A | B. | B | C. | C | D. | D |
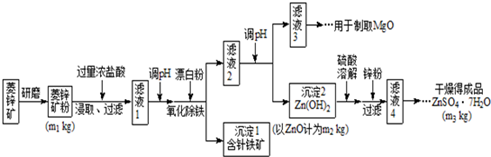
(1)将菱锌矿研磨成粉的目的是增大反应物接触面积,使反应更加充分.
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4.
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(5)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{{m}_{1}}$.
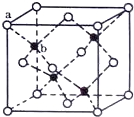 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性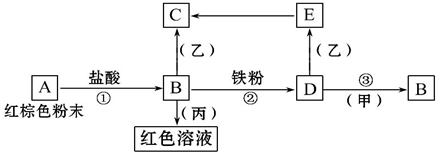 下列物质之间有如下反应关系,已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.
下列物质之间有如下反应关系,已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.