题目内容
15.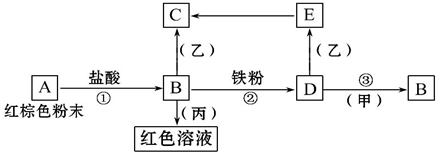 下列物质之间有如下反应关系,已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.
下列物质之间有如下反应关系,已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.(1)写出下列物质的化学式:BFe2O3,DFeCl2,甲Cl2,丙KSCN.
(2)写出E→C反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
写出②反应的离子方程式:Fe+2Fe3+=3Fe2+.
写出③反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
分析 E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色,则E是Fe(OH)2、C是Fe(OH)3,A是红棕色粉末,能和盐酸反应生成B,则A是Fe2O3、B是FeCl3,B和丙反应生成红色溶液,则丙是KSCN,B和Fe反应生成D,则D是FeCl2,D和乙反应生成Fe(OH)2,则乙是NaOH等,D和甲反应生成FeCl3,则甲是Cl2.
解答 解:E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色,则E是Fe(OH)2、C是Fe(OH)3,A是红棕色粉末,能和盐酸反应生成B,则A是Fe2O3、B是FeCl3,B和丙反应生成红色溶液,则丙是KSCN,B和Fe反应生成D,则D是FeCl2,D和乙反应生成Fe(OH)2,则乙是NaOH等,D和甲反应生成FeCl3,则甲是Cl2.
(1)通过以上分析知,B为Fe2O3、D为FeCl2、甲为Cl2、丙为KSCN,
故答案为:Fe2O3;FeCl2;Cl2;KSCN;
(2)E→C反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
②反应的离子方程式:Fe+2Fe3+=3Fe2+,
③反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe+2Fe3+=3Fe2+;2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查无机物推断,涉及Fe及其化合物性质与转化,物质的颜色及反应现象中颜色变化是推断突破口,掌握元素化合物性质以及铁离子、亚铁离子检验方法及现象,题目难度中等.

练习册系列答案
相关题目
3.除去乙醇中的少量水可选用的方法是( )
| A. | 盐析 | B. | 分液 | C. | 蒸馏 | D. | 过滤 |
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 使酚酞变红色的溶液:Na+、Ba2+、HCO3-、Cl- | |
| C. | pH=7的溶液:Fe3+、K+、SO42-、Br- | |
| D. | 0.1mol/LNaAlO2溶液:Al3+、Na+、SO42-、Cl- |
20.在NaCl溶液中含有少量的Na2S,欲将S2-除去,可加入( )
| A. | 稀硫酸 | B. | AgCl | C. | NaOH | D. | Ag2S |
4.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z 元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 0.1mol•L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | X分别与Y、Z、W所形成的化合物均为共价化合物 | |
| D. | X与Y所形成的化合物的沸点可能高于X与Z所形成的化合物 |
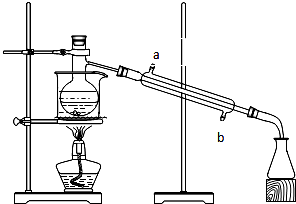 实验题:如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验
实验题:如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验