题目内容
18.下列物质中约含有6.02×1023个氯化氢分子的是( )| A. | 365g 10%的盐酸 | B. | 22.4L 氯化氢 (已知密度为1.7g/L) | ||
| C. | 36.5g HCl气体. | D. | 0.5mol HCl气体 |
分析 A、HCl溶于水后完全电离;
B、求出HCl的质量m=ρV,然后求出分子个数N=$\frac{m}{M}{N}_{A}$;
C、分子个数N=$\frac{m}{M}{N}_{A}$;
D、分子个数N=nNA.
解答 解:A、HCl溶于水后完全电离为氢离子和氯离子,故盐酸溶液中无HCl分子,故A错误;
B、HCl的质量m=ρV=22.4L×1.7g/L=38.08g,则分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{38.08g}{36.5g/mol}×{N}_{A}/mol$=1.04NA个,故B错误;
C、分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{36.5g}{36.5g/mol}×{N}_{A}/mol$=NA个,故C正确;
D、分子个数N=nNA=0.5mol×NA/mol=0.5NA个,故D错误.
故选C.
点评 本题考查了HCl分子个数的求算,掌握物质的组成和灵活运用公式是解题关键,难度不大.

练习册系列答案
相关题目
8.下列各组物质相互反应时,改变反应的条件、反应物的浓度或物质的量之比,生成的产物不变的是( )
| A. | 钠与空气 | B. | 铝盐与氢氧化钠溶液 | ||
| C. | CO2通入石灰水 | D. | 过氧化钠与水 |
6.阿伏加德罗常数用NA表示,下列叙述正确的是( )
| A. | 标准状况下,22.4L乙醇中含有的氧原子数目为NA | |
| B. | 6.4g的S2和S8混合物中,含硫原子总数为0.2NA | |
| C. | 0.1 mol•L-1的NaHSO4溶液中含有阳离子的总数为0.2NA | |
| D. | 7.8 g Na2O2与水反应,转移的电子总数为0.2NA |
13.下列事实中,一定能说明X、Y两种元素为同一主族的是( )
| A. | 原子半径X<Y | B. | 均有+3价 | ||
| C. | 最外层电子数均为5 | D. | 最外层均有2个电子 |
3.在下列化学反应方程式中,能用离子方程式S2-+2H+=H2S↑表示的有( )
①Na2S+2HCl=2NaCl+H2S↑ ②FeS+H2SO4(稀)=FeSO4+H2S↑
③ZnS+2HCl=ZnCl2+H2S↑ ④K2S+H2SO4(稀)=K2SO4+H2S↑
①Na2S+2HCl=2NaCl+H2S↑ ②FeS+H2SO4(稀)=FeSO4+H2S↑
③ZnS+2HCl=ZnCl2+H2S↑ ④K2S+H2SO4(稀)=K2SO4+H2S↑
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
2.与水发生的复分解反应称为水解反应.例如:Al2S3+6H2O═2Al(OH)3↓+3H2S↑.根据上述观点,下列说法中不正确的是( )
| A. | NaF 的水解产物是NaOH 和HF | B. | CaO2 的水解产物是Ca(OH)2 和H2O2 | ||
| C. | PCl3 的水解产物之一是PH3 | D. | Mg3N2水解产物是Mg(OH)2和NH3 |
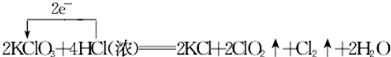 .
.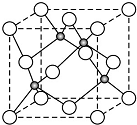 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题: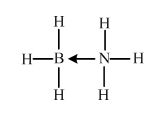 (必须标明配位键)
(必须标明配位键)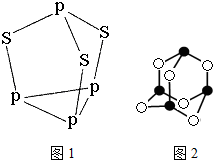 磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.
磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.