题目内容
11.把一根铁棒插入500L2mol/L的硫酸铜溶液中,反应一段时间后,将铁棒取出洗净烘干(设生成的铜全部附着在铁棒上)称重,铁棒比原来增重2.0g.求:(1)反应中生成铜的质量
(2)反应后溶液的体积仍为500mL,则该溶液中各溶质的物质的量浓度.
分析 根据发生的反应为Fe+CuSO4═FeSO4+Cu,利用差量法来计算.
解答 解:铁和硫酸铜反应方程式为:
Fe+CuSO4 ═FeSO4 +Cu△m
56g 1 1 1 (64-56)g=8g
n(CuSO4) n(Cu) 2g
$\frac{n(Cu)}{1}$=$\frac{n(CuSO4)}{1}$=$\frac{2g}{8g}$
n(Cu)=0.25mol,n(CuSO4)=0.25mol
m (Cu)=n(Cu)×M(Cu)=0.25mol×64g/mol=16g
C (CuSO4)=$\frac{n(CuSO4)}{V}$=$\frac{0.25mol}{0.5L}$=0.5mol/L
故答案为:(1)反应中生成铜的质量为16g;
(2)反应后溶液的体积仍为500mL,则该溶液中各溶质的物质的量浓度为0.5mol/L.
点评 本题考查学生利用化学反应方程式的计算,明确物质的质量变化及差量法来计算是解答本题的关键,难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
2.与水发生的复分解反应称为水解反应.例如:Al2S3+6H2O═2Al(OH)3↓+3H2S↑.根据上述观点,下列说法中不正确的是( )
| A. | NaF 的水解产物是NaOH 和HF | B. | CaO2 的水解产物是Ca(OH)2 和H2O2 | ||
| C. | PCl3 的水解产物之一是PH3 | D. | Mg3N2水解产物是Mg(OH)2和NH3 |
6.在恒温恒容的密闭容器中,有可逆反应2NO(g)+O2(g)?2NO2(g).下列能说明该反应已达到化学平衡状态的是( )
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | 反应容器中密度不随时间变化而变化 | |
| C. | 混合气体颜色深浅保持不变 | |
| D. | NO2、NO、O2的物质的量浓度之比为2:2:1 |
3.一种有机镁化合物X可用于制造防毒布料的涂布液,它可吸收空气中的甲醛,其反应原理如下(已配平):
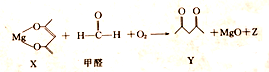
下列有关该反应的说法正确的是( )
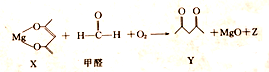
下列有关该反应的说法正确的是( )
| A. | X 是还原剂 | B. | Y的分子式为C5H8O2 | ||
| C. | Z的摩尔质量为44g | D. | 除去1mol甲醛时,转移2mole- |
20.下列关于CH4、H2、C三种能源物质的研究方向可行的是( )
| A. | 构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下使氢成为二次能源 | |
| B. | 寻找优质催化剂,使CO2与H2O反应生成CH4和O2,并放出热量 | |
| C. | 寻找优质催化剂,利用太阳能使大气中的CO2和海底开采的CH4合成合成气(CO、H2) | |
| D. | 将固态碳合成C60,以C60作燃料 |
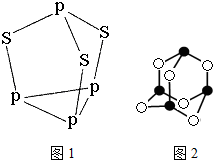 磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.
磷和砷元素形成的化合物在生活和生产中有重要的用途,回答下列问题.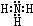 ,B的结构式为
,B的结构式为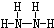 .
.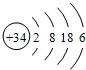 .
.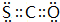 .
.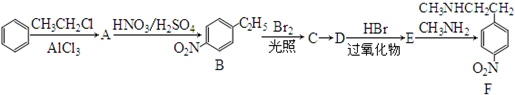
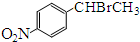 .
.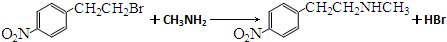 .
.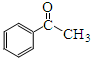 )常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线
)常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线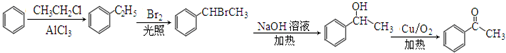 .
.