题目内容
现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同.计算混和物中碳酸锂和碳酸钡的物质的量之比.
考点:有关混合物反应的计算
专题:
分析:假设碳酸锂、碳酸钡的物质的量分别为xmol、ymol,表示出消耗HCl的物质的量,根据二者质量及消耗盐HCl的物质的量列方程计算解答.
解答:
解:100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同,及混合物消耗HCl为
×2=2mol,
假设碳酸锂、碳酸钡的物质的量分别为xmol、ymol,则:
整理得x:y=97:26
答:混和物中碳酸锂和碳酸钡的物质的量之比为97:26.
| 100g |
| 100g/mol |
假设碳酸锂、碳酸钡的物质的量分别为xmol、ymol,则:
|
整理得x:y=97:26
答:混和物中碳酸锂和碳酸钡的物质的量之比为97:26.
点评:本题考查混合物计算,难度中等,可以计算混合物平均相对分子质量,再利用十字交叉法解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
①已知t℃时AgCI的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )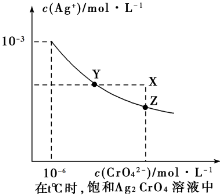

| A、在t℃时,Ag2CrO4的Ksp为1×10-9 |
| B、在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
| C、在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/LKCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
| D、在t℃时,反应Ag2CrO4(s)+2 Cl-(aq)?2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 |
下列说法正确的是( )
| A、金属钠应保存在水里以隔绝空气 |
| B、常温下铁能与水蒸气反应生成氢氧化铁和氢气 |
| C、可以用铁制品或铝制品容器盛冷的浓H2SO4 |
| D、铝较活泼,所以铝制品在空气中不能稳定存在 |
按照HCl、( )、Ca(ClO)2、KClO3、HClO4的排列规律,括号内应填入物质是( )
| A、Cl2 |
| B、NaClO |
| C、NaClO2 |
| D、ClO2 |
amol镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体的质量不可能为( )
| A、32a | B、40a |
| C、42a | D、46a |
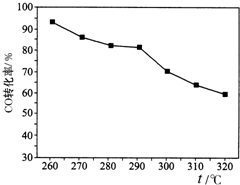 二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
