题目内容
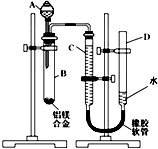 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.(1)A中试剂为
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②将B中剩余固体过滤,洗涤,干燥,称重;
③待B中不 再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂;
上述操作的顺序是
(4)B中发生反应的化学反应方程式:
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B 中剩余固体的质量为c g,则铝的相对原子质量为
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将
考点:实验装置综合,相对分子质量的测定,探究物质的组成或测量物质的含量
专题:实验题,实验设计题
分析:(1)Mg、Al均可以和酸反应,因此不可以用酸来实验,由于Al可以和碱反应而不和Mg反应,则可以用NaOH与Al反应制得H2,然后用排水法收集H2,以计算Al的量;
(2)由于Al表面容易生成氧化膜,因而要用酸处理;
(3)整个操作过程及原理是:检查气密性;记录起始液面;加入碱反应;不产生气体后,记录C中的液面,两者相减即为产生H2的量;最后称得的固体即为Mg的质量.在读数时要注意D、C液面相平,否则气体将受压,造成读数不准;
(4)B中发生的是Al与碱的反应;
(5)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量,而n(Al)可以由产生的H2获得;
(6)未洗涤,则造成(a-c)变小,则由(5)的结果可进行判断.
(2)由于Al表面容易生成氧化膜,因而要用酸处理;
(3)整个操作过程及原理是:检查气密性;记录起始液面;加入碱反应;不产生气体后,记录C中的液面,两者相减即为产生H2的量;最后称得的固体即为Mg的质量.在读数时要注意D、C液面相平,否则气体将受压,造成读数不准;
(4)B中发生的是Al与碱的反应;
(5)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量,而n(Al)可以由产生的H2获得;
(6)未洗涤,则造成(a-c)变小,则由(5)的结果可进行判断.
解答:
解:(1)根据铝镁的化学性质,铝镁都能与酸反应放出氢气,但铝还能与碱(如NaOH溶液)反应放出氢气,而镁不能,要测定铝镁合金中铝的质量分数,应选择NaOH溶液,
故答案为:NaOH溶液;
(2)铝镁的表面都容易形成一层氧化膜,在实验前必须除去,故答案为:除去铝镁合金表面的氧化膜;
(3)实验时,记下量气管中C的液面位置,再加入NaOH溶液开始反应,待反应完毕并冷却至室温后,记录量气管中C的液面位置,最后将B中剩余固体过滤,洗涤,干燥,称重;量气管读数时为使里面气体压强与外界大气压相等,必须使D和C两管中液面相平,
故答案为:①④③②;使D和C的液面相平;
(4)B管中发生铝与NaOH溶液的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)铝镁合金的质量为a g,B中剩余固体镁的质量为c g,则参加反应的铝的质量为(a-c)g,设铝的相对原子质量为M,则
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2M 3×22400ml
(a-c)g bml
解得:M=
,
故答案为:
;
(6)铝的质量分数为:
,实验过程中,若未洗涤过滤所得的不溶物,c值偏大,铝的质量分数偏小,
故答案为:偏小.
故答案为:NaOH溶液;
(2)铝镁的表面都容易形成一层氧化膜,在实验前必须除去,故答案为:除去铝镁合金表面的氧化膜;
(3)实验时,记下量气管中C的液面位置,再加入NaOH溶液开始反应,待反应完毕并冷却至室温后,记录量气管中C的液面位置,最后将B中剩余固体过滤,洗涤,干燥,称重;量气管读数时为使里面气体压强与外界大气压相等,必须使D和C两管中液面相平,
故答案为:①④③②;使D和C的液面相平;
(4)B管中发生铝与NaOH溶液的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)铝镁合金的质量为a g,B中剩余固体镁的质量为c g,则参加反应的铝的质量为(a-c)g,设铝的相对原子质量为M,则
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2M 3×22400ml
(a-c)g bml
解得:M=
| 33600(a-c) |
| b |
故答案为:
| 33600(a-c) |
| b |
(6)铝的质量分数为:
| (a-c) |
| a |
故答案为:偏小.
点评:本题考查了探究实验、混合物的计算和测定,题目难度中等,注意把握镁铝的化学性质,侧重于元素化合物知识的综合应用的考查.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
10.41克纯铁丝溶于过量的盐酸中,在加热条件下,用5.05克的KNO3去氧化溶液中的Fe2+,待反应完后,剩余Fe2+还需要24mL0.3mol/L的KMnO4溶液才能完全氧化成Fe3+,此时KMnO4转化为Mn2+,则KNO3的还原产物为( )
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2O5 |
下列各组稀溶液,不用其他试剂,就可以将它们区分开的是( )
| A、氯化铁、氯化钡、碳酸钠、硫酸 |
| B、盐酸、硝酸铵、氢氧化钠、硝酸钠 |
| C、氢氧化钠、稀硫酸、碳酸钠、硫酸氢钠 |
| D、氯化钡、硫酸钠、氯化钙、硝酸钙 |
证明某白色固体中含有Cl-的正确操作方法是( )
| A、加入AgNO3溶液和稀硝酸,看是否有白色沉淀生成 |
| B、溶于水后加入AgNO3溶液,看是否有白色沉淀生成 |
| C、加入AgNO3溶液,看是否有白色沉淀生成 |
| D、溶于水后先加入Ba(NO3)2溶液,再加入AgNO3溶液和稀硝酸,看是否有白色沉淀生成 |
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质. 二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下:
二甲醚(CH3OCH3)是一种新型能源.由合成气(组成为H2、CO和少量的CO2)合成二甲醚的三步反应如下: