题目内容
9.丙烯是一种重要的化工原料.2000年以来,我国丙烯的使用量已超过乙烯,且一直保持增长趋势.现以丙烯为原料,合成环酯J.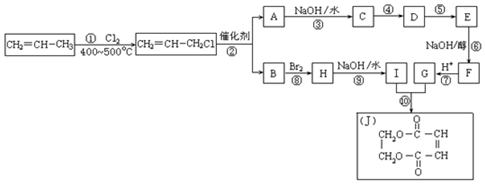
已知:烯烃复分解反应是指在催化剂作用下,实现
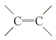 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.2CH2═CHCH3$\stackrel{催化剂}{→}$CH3CH═CHCH3+CH2═CH2
请按要求填空:
(1)反应①的化学反应类型是取代反应.
(2)反应④是与HCl加成,设计这一步反应的目的是保护分子中碳碳双键不被氧化.
(3)反应②的化学方程式为2CH2═CH-CH2Cl$\stackrel{催化剂}{→}$ClCH2-CH═CH-CH2Cl+CH2═CH.
(4)物质E的结构简式是
 .
.(5)有机化合物C有多种同分异构体,请写出其中属于酯类且能发生银镜反应的所有同分异构体的结构简式HCOOCH2CH2CH3、HCOOCH(CH3)2.
分析 丙烯与氯气在加热条件下发生取代反应生成CH2=CHCH2Cl,由反应信息可知,CH2=CHCH2Cl在催化剂条件下发生复分解反应生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应生成C,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2.B与溴发生加成反应生成H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I为HOCH2-CH2OH.A在氢氧化钠水溶液、加热条件下发生反应生成C为HOCH2CH=CHCH2OH,由J的结构可知,G为HOOC-CH=CH-COOH,由转化关系可知,结合反应④是C与HCl加成生成D,保护C=C不被氧化,D再氧化可得E,故D为HOCH2CH2CHClCH2OH,E为
解答 解:丙烯与氯气在加热条件下发生取代反应生成CH2=CHCH2Cl,由反应信息可知,CH2=CHCH2Cl在催化剂条件下发生复分解反应生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应生成C,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2.B与溴发生加成反应生成H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I为HOCH2-CH2OH.A在氢氧化钠水溶液、加热条件下发生反应生成C为HOCH2CH=CHCH2OH,由J的结构可知,G为HOOC-CH=CH-COOH,由转化关系可知,结合反应④是C与HCl加成生成D,保护C=C不被氧化,D再氧化可得E,故D为HOCH2CH2CHClCH2OH,E为
(1)反应①为丙烯的取代反应,所以反应类型是取代反应,故答案为:取代反应;
(2)反应④是与HCl加成,设计这一步反应的目的是保护分子中碳碳双键不被氧化,
故答案为:保护分子中碳碳双键不被氧化;
(3)该反应方程式为2CH2═CH-CH2Cl$\stackrel{催化剂}{→}$ClCH2-CH═CH-CH2Cl+CH2═CH,
故答案为:2CH2═CH-CH2Cl$\stackrel{催化剂}{→}$ClCH2-CH═CH-CH2Cl+CH2═CH 2,
(4)通过以上分析知,E结构简式为

(5)有机化合物C有多种同分异构体,其中属于酯类且能发生银镜反应的所有同分异构体的结构简式为HCOOCH2CH2CH3、HCOOCH(CH3)2,
故答案为:HCOOCH2CH2CH3、HCOOCH(CH3)2.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确有机物官能团及其性质关系、物质之间的转化是解本题关键,知道每一步发生的反应及反应类型,题目难度不大.

| A. | 放出248 kJ的热量 | B. | 吸收248 kJ的热量 | ||
| C. | 放出183 kJ的热量 | D. | 吸收183 kJ的热量 |
| A. | 有电子转移(得失或偏移)的化学反应都是氧化还原反应 | |
| B. | p电子原子轨道的平均半径随电子层的增大而增大 | |
| C. | 电子是在原子核外,能量由低到高的不同电子层上分层排布的 | |
| D. | 氢原子电子云图中小黑点表示电子的运动轨迹 |
| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |
| 温度℃ | 450 | 500 | 550 | 600 |
| SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
(2)能判断该反应是否达到平衡状态的是ACF
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO3的浓度不变 D.C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F.V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol•L-1.
①0~2min之间,O2的反应速率为0.08mol•L-1•min-1.
②此时的温度为600℃.
③此温度下的平衡常数为$\frac{400}{21}$(可用分数表示).
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将正向移动.

 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。