题目内容
0.1mol/L NH4Cl溶液中,下列叙述错误的是 ( )
A.c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.c(Cl—)>c(NH4+)>c(H+)>c(OH—)
C.c(NH4+)+c(H+)=c(Cl—)+c(OH—)
D.c(NH4+)+c(NH3 ·H2O)=c(Cl—)
·H2O)=c(Cl—)
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.不可能是炔烃的加成产物的是( )
| A. | 乙烷 | B. | 异丁烷 | C. | 异戊烷 | D. | 2,3-二甲基戊烷 |
16. 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4是N2的同素异形体 | |
| C. | N4分子中N-N键角为109°28′ | |
| D. | 1 mol N4转变成N2将吸收882 kJ热量 |
12.下列叙述正确的是( )
| A. | 碱式碳酸铜、烧碱均属碱 | |
| B. | CO、SO2均属酸性氧化物 | |
| C. | 凡能电离出H+的化合物均属酸 | |
| D. | 盐类物质一定含有金属离子或铵根离子 |
18.形成 1mol H-Cl键时放出431kJ的能量,断裂1molCl-Cl键时吸收243kJ的能量,断裂1mol H-H键时吸收436kJ的能量,则1mol H2(g)与1mol Cl2(g)完全反应生成2mol HCl(g)的能量变化为( )
| A. | 放出248 kJ的热量 | B. | 吸收248 kJ的热量 | ||
| C. | 放出183 kJ的热量 | D. | 吸收183 kJ的热量 |
7.乙酸异戊酯(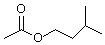 )是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
)是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
实验步骤:在烧瓶中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热烧瓶,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁晶体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯2.6g.回答下列问题:
(1)写出制取乙酸异戊酯的化学方程式CH3COOH+(CH3)2CHCH2CH2O$?_{△}^{浓硫酸}$CH3COOCH2CH2CH(CH3)2+H2O.
(2)冷凝管的作用是,碎瓷片的作用是分别为冷凝回流;防暴沸.
(3)若乙酸异戊酯产率偏低,其原因可能是ABC (填序号).
A.原料没有充分反应
B.发生了副反应
C.在进行蒸馏纯化操作时,从143℃开始收集馏分
(4)在洗涤、分液操作中,应充分振荡,然后静置,待分层后D (填序号).
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(5)实验中加入少量无水硫酸镁的目的是干燥乙酸异戊酯.
(6)本实验的产率是B(填序号)
A.30% B.40% C.50% D.60%
 )是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
)是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:实验步骤:在烧瓶中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热烧瓶,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁晶体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯2.6g.回答下列问题:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
(2)冷凝管的作用是,碎瓷片的作用是分别为冷凝回流;防暴沸.
(3)若乙酸异戊酯产率偏低,其原因可能是ABC (填序号).
A.原料没有充分反应
B.发生了副反应
C.在进行蒸馏纯化操作时,从143℃开始收集馏分
(4)在洗涤、分液操作中,应充分振荡,然后静置,待分层后D (填序号).
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(5)实验中加入少量无水硫酸镁的目的是干燥乙酸异戊酯.
(6)本实验的产率是B(填序号)
A.30% B.40% C.50% D.60%
14.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |
5.甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇.

(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)…Ⅰ.CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.0030 mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0…Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
A.则上表中剩余的实验条件数据:a=150、b=$\frac{1}{3}$.
B.根据反应Ⅱ的特点,图2是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.

(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)…Ⅰ.CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.0030 mol/(L•min).
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H<0…Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | a | $\frac{1}{3}$ | 5 |
| 3 | 350 | b | 5 |
B.根据反应Ⅱ的特点,图2是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=0.1MPa.

