题目内容
7.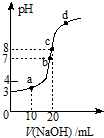 常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )
常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )| A. | a、b、c三点所示溶液导电能力最强的是c点对应的溶液 | |
| B. | 在c点溶液中:c(H+)+c(HA)=c(OH-) | |
| C. | 25℃,HA的电离平衡常数约为1.0×10-5 | |
| D. | a、b、c、d四点所示溶液中水的电离程度最大的是b点对应的溶液 |
分析 A.c点加入20mL氢氧化钠溶液,此时氢氧化钠与HA恰好反应,与a、b点相比,c点溶液中离子浓度最大,溶液导电性最强;
B.c点溶质为NaA,根据质子守恒判断;
C.根据图示可知,0.10mol/L的HA溶液的pH=3,结合电离平衡常数的表达式进行计算;
D.氢氧化钠与HA恰好反应时水的电离程度最大,中性溶液时不影响水的电离,酸性或碱性溶液中抑制了水的电离.
解答 解:A.a、b、c三点中,a、b点氢氧化钠不足,HA有剩余,而c点氢氧化钠与HA恰好反应生成NaA,与a、b点相比,c点溶液中离子浓度最大,所以导电能力最强的是c点对应的溶液,故A正确;
B.在c点溶液中的溶质为NaA,根据质子守恒可得:c(H+)+c(HA)=c(OH-),故B正确;
C.0.10mol/L的一元酸HA溶液的pH=3,则溶液中氢离子浓度为:c(H+)=10-3mol/L,c(A-)≈c(H+)=10-3mol/L,c(HA)=0.10mol/L-c(A-)≈0.10mol/L,则HA的电离平衡常数为:$\frac{1{0}^{-3}×1{0}^{-3}}{0.10}$=1.0×10-5,故C正确;
D.a、b、c、d四点所示溶液中,b点溶液的pH=7,不影响水的电离,a、d点都抑制了水的电离,只有c点恰好反应生成NaA,A-水解促进了水的电离,水的电离程度最大的是c点对应的溶液,故D错误;
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握水的电离及其影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下表是几种弱酸常温下的电离平衡常数:
(1)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,则酸性最强的是H3PO4,最弱的是HPO42-.
(2)多元弱酸的二级电离程度远小于一级电离的原因是一级电离产生的H+对二级电离有抑制作用.
(3)温度相同时,同浓度的CH3COO-、HCO3-、CO32-、S2-的水解能力由强到弱的顺序为S2->CO32->HCO3->CH3COO-.
(4)在CH3COONa溶液中在相关离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(5)根据K值大小判断下列反应能否发生:CH3COOH+H2PO4-→不能(填“能”或“不能”,下同) H2CO3+HS-→能.
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(2)多元弱酸的二级电离程度远小于一级电离的原因是一级电离产生的H+对二级电离有抑制作用.
(3)温度相同时,同浓度的CH3COO-、HCO3-、CO32-、S2-的水解能力由强到弱的顺序为S2->CO32->HCO3->CH3COO-.
(4)在CH3COONa溶液中在相关离子浓度由大到小的顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(5)根据K值大小判断下列反应能否发生:CH3COOH+H2PO4-→不能(填“能”或“不能”,下同) H2CO3+HS-→能.
19.下列叙述正确的是(NA表示阿伏加德罗常数值)( )
| A. | 1molC60F60分子中非极性共价键数目为60NA | |
| B. | 2.1gDTO分子中所含中子数为NA | |
| C. | 4.6gN2O4和NO2混合物中含的电子数为2.3NA | |
| D. | aml1mol/L的H2B溶液中,测得溶液中无H2B分子,则溶液中阴离子数为aNA |
16.将1LpH=13 的氨水溶液加入水稀释到10.0L后,下列微粒浓度增大的是( )
| A. | c[NH3•H2O] | B. | c[H+] | C. | c[OH-] | D. | c[NH4+] |
17.下列说法中正确的是( )
| A. | 共价化合物在熔融态时不能导电 | |
| B. | 氢键是一种化学键,且它比分子间作用力要稍强 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 双原子分子中的共价键一定是非极性键 |
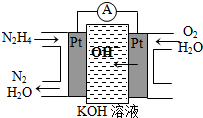 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题