题目内容
19.下列叙述正确的是(NA表示阿伏加德罗常数值)( )| A. | 1molC60F60分子中非极性共价键数目为60NA | |
| B. | 2.1gDTO分子中所含中子数为NA | |
| C. | 4.6gN2O4和NO2混合物中含的电子数为2.3NA | |
| D. | aml1mol/L的H2B溶液中,测得溶液中无H2B分子,则溶液中阴离子数为aNA |
分析 A、C60F60分子中非极性共价键为90个;
B、DTO的摩尔质量为21g/mol;
C、N2O4和NO2的最简式均为NO2;
D、aml1mol/L的H2B溶液中,测得溶液中无H2B分子,故H2B为强酸.
解答 解:A、C60F60分子中非极性共价键为90个,1 molC60F60分子中非极性共价键数目为90NA,A错误;
B、2.1gDTO分子的物质的量为0.1mol,所含中子数为1.1NA ,B错误;
C、4.6gN2O4和NO2混合物中含N原子0.1mol,含O原子0.2mol,所含的电子数为2.3NA,C正确;
D、aml 1mol/L的H2B溶液中,含H2B a×10-3mol,测得溶液中无H2B分子,则溶液中B2-阴离子数为a×10-3×NA,而水也能电离出氢氧根,故溶液中阴离子的个数大于aNA个,D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
10.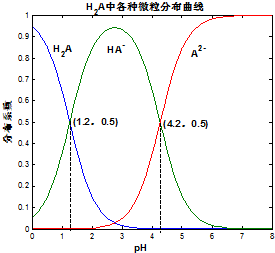 常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
 常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在 0.1mol/L NaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的 Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
10.用容量瓶配制一定物质的量浓度的溶液,下列操作会使配制的NaOH溶液浓度偏低的是( )
| A. | 称量12.5g固体NaOH时,将砝码放在左盘上,NaOH放在右盘上 | |
| B. | 选用的容量瓶中有少量蒸馏水 | |
| C. | 定容时俯视刻度线 | |
| D. | 定容摇匀后,液面下降,又加水至刻度线 |
7.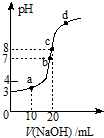 常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )
常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )
 常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )
常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )| A. | a、b、c三点所示溶液导电能力最强的是c点对应的溶液 | |
| B. | 在c点溶液中:c(H+)+c(HA)=c(OH-) | |
| C. | 25℃,HA的电离平衡常数约为1.0×10-5 | |
| D. | a、b、c、d四点所示溶液中水的电离程度最大的是b点对应的溶液 |
4.在下列各组物质中,属于同系物的一组是( )
| A. | 1,1-二溴乙烷和1,2-二溴乙烷 | B. | 苯和甲苯 | ||
| C. | 乙二醇和丙三醇 | D. | 乙烯和环丙烷 |
11.下列指定溶液中一定能大量共存的离子组是( )
| A. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- | |
| B. | 中性溶液中:K+、Fe3+、Cl-、SO42- | |
| C. | AlO2一的浓度为0.1 mol/L的溶液中:K+、Na+、HCO3-、SO42- | |
| D. | Na2S溶液中:SO42-、K+、Cu2+、Cl- |
8.下列物质与水反应生成强酸的是( )
| A. | Na2O | B. | SO3 | C. | CO2 | D. | NO |
9. 甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
 甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差26 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |