题目内容
15.已知1g氢气完全燃烧生成水蒸气时,放出热量121kJ.且氢气中1mol H-H键断裂时吸收热量为436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则破坏1mol氧氧间的共价键需要吸收的热量为( )| A. | 932kJ | B. | 859 kJ | C. | 538 kJ | D. | 496kJ |
分析 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,1molH2O含有2molH-O键,1molH2中1mol H-H键,根据化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,结合反应方程式进行计算.
解答 解:已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,则2mol氢气完全燃烧生成水蒸气时放出热量4×121kJ=484kJ,化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设破坏1mol氧氧间的共价键需要吸收的热量为x,根据方程式:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,则:4×121kJ=463kJ×4-(x+2×436kJ),解得x=496KJ,
故选D.
点评 本题考查学生化学反应中的能量变化知识,注意化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量是解题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.反应:2A(g)+3B(g)?C(g)+4D(g),速率最快的是( )
| A. | v(A)=2.0mol•L-1•min-1 | B. | v(B)=4.0mol•L-1•min-1 | ||
| C. | v(C)=0.1mol•L-1•s-1 | D. | v(D)=0.3mol•L-1•s-1 |
6.氢气还原氧化铜:CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O,在该反应中( )
| A. | CuO作还原剂 | B. | 铜元素化合价降低 | ||
| C. | CuO作氧化剂 | D. | 铜元素被氧化 |
10.下列各项中正确的是( )
| A. | 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯 | |
| B. | 淀粉与纤维素不互为同分异构体,但二者完全水解的产物相同 | |
| C. | 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程 | |
| D. | 对苯二甲酸( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚醋纤维( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚醋纤维( ) ) |
20.下列叙述中正确的是( )
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 苯、溴水、铁粉混合制成溴苯 | |
| C. | 沸点:戊烷>丁烷>乙烷 | |
| D. | 由丙烯加溴制1,2-二溴丙烷 |
7.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 投入足量漂白粉后的溶液中:Fe2+、H+、Cl-、SO42- | |
| B. | 0.1mol/LFeCl3溶液中:Na+、Ba2+、NO3-、SCN- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Ca2+、Cl、NO3- | |
| D. | 水电离的c(OH-)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |
4.下列实验操作、现象所对应的相关结论正确的是( )
| 实验 | 现象 | 结论 | |
| A | 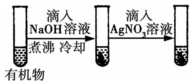 | 最后试管中出现白色沉淀 | 有机物中含 有氯原子 |
| B | 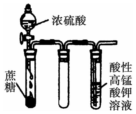 | 酸性高锰酸钾溶液褪色 | 浓硫酸有 吸水性 |
| C | 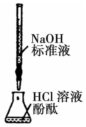 | 最后一滴标准液使酚酞由无色变为浅红色,且30s内不褪色 | 滴定达到 终点 |
| D | 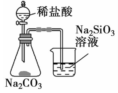 | Na2SiO3溶液变浑浊 | 非金属性 Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
5.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法正确的是( )
| A. | 18O 存在于水中 | |
| B. | 18O 存在于乙酸乙酯和乙醇中 | |
| C. | 18O 存在于乙酸乙酯和水中 | |
| D. | 生成的乙酸乙酯的相对分子质量为88 |
