题目内容
5.用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法正确的是( )| A. | 18O 存在于水中 | |
| B. | 18O 存在于乙酸乙酯和乙醇中 | |
| C. | 18O 存在于乙酸乙酯和水中 | |
| D. | 生成的乙酸乙酯的相对分子质量为88 |
分析 羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程为:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯,即酸去羟基醇去羟基氢,据此判断含有18O的化合物,并计算出生成的乙酸乙酯的相对分子量,以此解答该题.
解答 解:乙酸与乙醇反应乙酸提供羟基,醇提供羟基氢原子,结合生成水,其余部分互相结合成酯,所以CH3CH218OH与乙酸反应方程式为:CH3COOH+CH3CH218OH CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,
CH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,
生成的乙酸乙酯为:CH3CO18OCH2CH3,该酯的相对分子质量为90,
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查酯化反应的原理与特点,难度不大,注意羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯.

练习册系列答案
相关题目
15.已知1g氢气完全燃烧生成水蒸气时,放出热量121kJ.且氢气中1mol H-H键断裂时吸收热量为436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则破坏1mol氧氧间的共价键需要吸收的热量为( )
| A. | 932kJ | B. | 859 kJ | C. | 538 kJ | D. | 496kJ |
16.“嫦娥一号”需完成的四大科学目标之一是探测下列14种元素K、Th、U、O、Si、Mg、Al、Ca、Fe、Ti、Na、Cr、Cd在月球的含量和分布,其中属于短周期元索的有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
13.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 分子总数为NA的SO2和CO2的混合气体中含有的氧原子数为2NA | |
| B. | 0.1mol/L(NH4)2SO4溶液与0.2mol/LNH4Cl溶液中的NH4+数目相同 | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 1molNa与足量O2反应生成了混合物,Na失去NA个电子 |
20.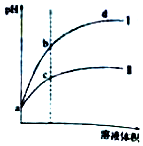 某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释.平衡时的pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释.平衡时的pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
 某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释.平衡时的pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下,体积相同、pH相同的盐酸和氯化铵溶液分别稀释.平衡时的pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | 曲线Ⅱ对应氯化铵溶液 | |
| B. | 与等浓度的NaOH溶液恰好反应时曲线Ⅰ对应的溶液消耗NaOH溶液体积大 | |
| C. | b点比c点水的电离程度大 | |
| D. | c、d两点的离子积常数不等 |
10.图装置中,“→”表示电子的移动方向,则电极材料A、B分别可能是( )


| A. | 石墨、石墨 | B. | Cu、Al | C. | Mg、石墨 | D. | Ag、Zn |
17. 利用原电池原理除去废水中的乙酸钠和对氯酚(
利用原电池原理除去废水中的乙酸钠和对氯酚( ),其原理如图所示,下列说法不正确的是( )
),其原理如图所示,下列说法不正确的是( )
 利用原电池原理除去废水中的乙酸钠和对氯酚(
利用原电池原理除去废水中的乙酸钠和对氯酚( ),其原理如图所示,下列说法不正确的是( )
),其原理如图所示,下列说法不正确的是( )| A. | 电流方向从A极沿导线流向B极 | |
| B. | 每转移2mole-,有0.25mol CH3COO-被氧化 | |
| C. | 当外电路中有2mole-转移时,进入A极区的H+的个数为2NA | |
| D. | A极的电极反应式为 +H++e-═Cl-+ +H++e-═Cl-+ |
14.短周期元素X、Y、Z、W的原子半径依次增大,其简单氢化物中X、Y、Z、W的化合价如表所示:
下列说法正确的是( )
| 元素 | X | Y | Z | W |
| 化合价 | -1 | -2 | -2 | -3 |
| A. | 最高价氧化物对应水化物的酸性:W>Z | |
| B. | 元素的非金属性:X>Y | |
| C. | 氢化物的沸点:Z>Y | |
| D. | 元素Y不存在同素异形现象 |
16.有机物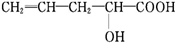 在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )
在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )
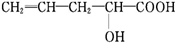 在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )
在不同条件下至少可能发生六种不同类型的有机反应:①加成;②取代;③消去;④氧化;⑤酯化;⑥加聚.其中由于分子结构中含-OH可能发生的反应有( )| A. | ①④⑥ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ①②③④ |