题目内容
5.反应:2A(g)+3B(g)?C(g)+4D(g),速率最快的是( )| A. | v(A)=2.0mol•L-1•min-1 | B. | v(B)=4.0mol•L-1•min-1 | ||
| C. | v(C)=0.1mol•L-1•s-1 | D. | v(D)=0.3mol•L-1•s-1 |
分析 不同物质表示化学反应速率之比等于其化学计量数之比,则反应速率与化学计量数的比值越大,表示反应速率越快,注意单位保持一致.
解答 解:A.$\frac{v(A)}{2}$=$\frac{2.0}{2}$mol•L-1•min-1=1.0mol•L-1•min-1;
B.$\frac{v(B)}{3}$=$\frac{4.0}{3}$mol•L-1•min-1=$\frac{4}{3}$mol•L-1•min-1;
C.$\frac{v(C)}{1}$=0.1mol/(L•s)=6mol•L-1•min-1;
D.$\frac{v(D)}{4}$=$\frac{0.3}{4}$mol•L-1•min-1=0.075mol•L-1•min-1,
所以反应速率快慢为:v(C)>v(B>v(A)>v(D),
故选C.
点评 本题考查化学反应速率与化学计量数的关系,题目难度不大,注意理解把握化学反应速率与化学计量数的关系,注意比值法应用及单位统一,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列说法不正确的是( )
| A. | 煤的气化、液化和石油的分馏均为物理变化 | |
| B. | 蛋白质水解生成氨基酸的反应属于取代反应 | |
| C. | 丙烷与氯气反应可得到沸点不同的4 种二氯代物 | |
| D. | 乙酸和硬脂酸(C17H35COOH)互为同系物 |
17.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 冷浓硝酸不能用铝制容器盛装 | |
| B. | 钠可从钴盐溶液中置换出钴单质 | |
| C. | 食盐中加入碘单质可以预防甲状腺肿大 | |
| D. | 光导纤维遇氢氧化钠溶液易“断路” |
14.下列化学工业所采取的措施中,能用勒夏特列原理解释的是( )
| A. | 合成氨工业:温度控制在500℃左右 | |
| B. | 接触法制硫酸:SO2在常压下催化氧化 | |
| C. | 侯氏制碱法:往母液中继续加入食盐和氨气 | |
| D. | 石油化工:将分馏得到的重油在高温下裂化 |
10.下列有关元素周期表的说法正确的是( )
| A. | 第IA的元素全部是金属元素 | |
| B. | 元素周期表有18个族 | |
| C. | 元素周期表含元素最多的族是第ⅢB族 | |
| D. | 短周期是指第一、二、三、四周期 |
17.下列相关反应的离子方程式书写正确的是( )
| A. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O | |
| B. | 稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe2++NO↑+2H2O | |
| C. | Ba(HCO3)2溶液中加入过量的NaOH溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
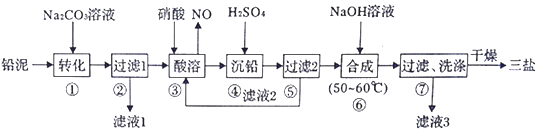
14.(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
(2)这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):④→②→①→③.
(3)A瓶溶液的作用是验证产物中是否有二氧化硫,B瓶溶液的作用是除去二氧化硫,装置②中所加固体药品是(化学式)CuSO4.
(4)装置③中所盛溶液是澄清石灰水,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O.证明有二氧化碳生成的实验现象是C瓶中品红溶液不褪色,③中澄清石灰水变为浑浊
(5)装置B中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
| 编号 | ① | ② | ③ | ④ |
| 装置 | 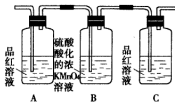 | 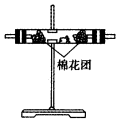 | 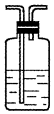 | 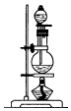 |
(3)A瓶溶液的作用是验证产物中是否有二氧化硫,B瓶溶液的作用是除去二氧化硫,装置②中所加固体药品是(化学式)CuSO4.
(4)装置③中所盛溶液是澄清石灰水,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O.证明有二氧化碳生成的实验现象是C瓶中品红溶液不褪色,③中澄清石灰水变为浑浊
(5)装置B中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
15.已知1g氢气完全燃烧生成水蒸气时,放出热量121kJ.且氢气中1mol H-H键断裂时吸收热量为436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则破坏1mol氧氧间的共价键需要吸收的热量为( )
| A. | 932kJ | B. | 859 kJ | C. | 538 kJ | D. | 496kJ |