题目内容
8.由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是( )| 选项 | 反应类型 | 反应条件 |
| A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
| B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
| C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
| D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
分析 由CH3CH2CH2Br制备CH3CH(OH)CH2OH,由逆合成法可知,CH3CH(OH)CH2OH→CH3CH(Br)CH2Br→CH3CH=CH2→CH3CH2CH2Br,以此来解答.
解答 解:由CH3CH2CH2Br制备CH3CH(OH)CH2OH,
①先发生CH3CH2CH2Br→CH3CH=CH2,为消去反应,反应条件为NaOH醇溶液/加热(KOH醇溶液/加热);
②再发生CH3CH=CH2→CH3CH(Br)CH2Br,为加成反应,反应条件为常温;
③最后发生CH3CH(Br)CH2Br→CH3CH(OH)CH2OH,为水解反应,属于取代反应,反应条件为KOH水溶液/加热,
故选B.
点评 本题考查有机物的合成,为高频考点,把握官能团与性质、逆合成法为解答关键,侧重分析与应用能力的考查,注意合成中官能团的变化,题目难度不大.

练习册系列答案
相关题目
18.下列溶液一定是碱性的是( )
| A. | pH=6的某电解质的溶液 | B. | c(OH-)>1×10-7mol/L | ||
| C. | 溶液中含有OH- | D. | 溶液中c(OH-)>c(H+) |
19.表是25℃时四种酸的电离平衡常数:
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-
(2)25℃时,向向0.1mol•L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
(3)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为c(Na+)>c(A-)>c(OH-)>c(H+)
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2,某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法可行(填“可行”或“不可行”),理由是NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行
(6)已知NaHCO3溶液中存在HCO3??H++CO32-,加水稀释时溶液中的c(H+)将增大(填“增大”或“减小”)
| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1 =4.1×10-7 Ka2 =5.6×10-11 |
(2)25℃时,向向0.1mol•L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
(3)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为c(Na+)>c(A-)>c(OH-)>c(H+)
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2,某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法可行(填“可行”或“不可行”),理由是NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行
(6)已知NaHCO3溶液中存在HCO3??H++CO32-,加水稀释时溶液中的c(H+)将增大(填“增大”或“减小”)
16.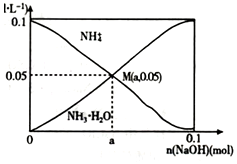 常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
 常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在 M 点时,n(OH- )-n(H+)=(a-0.05)mol | |
| C. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c( NH4+)>c(OH-)>c(H+) | |
| D. | 随着NaOH的加入,一定存在c(Cl-)+c(0H-)+c(NH3•H20)>0.lmol•L-1 |
13.下列叙述正确的是( )
| A. | c( NH4+)相等的NH4Cl溶液和(NH4)2Fe( SO4)2溶液中:c(Cl-)>c( SO42-) | |
| B. | 常温下,将pH=5的H2S04溶液加水稀释1000倍,所得溶液的pH=8 | |
| C. | 0.2 mol/LCH3COOH溶液与0.1 mol/LNaOH溶液等体积混合所得的溶液中:c( CH3COOH)+c( CH3COO -)=2c(Na+)=0.2 mol/L | |
| D. | 用甲基橙作指示剂,用标准盐酸滴定未知浓度的氨水,至终点时,溶液中:c(NH4+)=c(Cl-) |
3.下列叙述中,指定粒子的数目约为6.02×1023的是( )
| A. | 1.6gCH4中含有的分子数 | |
| B. | 1molH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下22.4LCO气体中含有的分子数 |
20.有关溴乙烷的下列叙述中,正确的是( )
| A. | 溴乙烷不溶于水,能溶于大多数有机溶剂 | |
| B. | 溴乙烷与NaOH的醇溶液共热可生成乙醇 | |
| C. | 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 | |
| D. | 溴乙烷通常用乙烷与液溴直接反应来制取 |
1.已知A是一种金属单质,B为淡黄色固体,其转化关系如图所示,则以下有关C的性质描述错误的是( )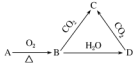

| A. | C与CO2能继续反应 | B. | 与澄清石灰水反应产生白色沉淀 | ||
| C. | 与足量盐酸反应放出气体 | D. | 受热易分解 |
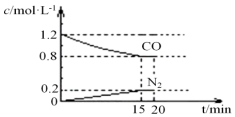 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.