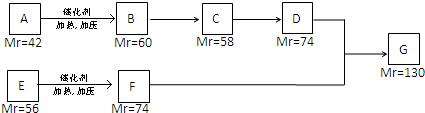
题目内容
短周期元素Q、W、X、Y、Z的原子序数依次增大,X元素的颜色反应呈黄色,Q原子的最外层电子数是其内层电子数的2倍,W、Z原子的最外层电子数相同,Z元素的核电荷数是W的2倍,Y是地壳中含量最多的金属元素.下列说法不正确的是( )
| A、工业上常用电解的方法制备X、Y的单质 |
| B、元素Q和Z能形成QZ2型的共价化合物 |
| C、原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Q) |
| D、元素X、Y的最高价氧化物对应的水化物之间能发生反应 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色,则X为Na元素;Q元素的原子最外层电子数是其内层电子数的2倍,Q元素原子有2个电子层,最外层电子数为4,故Q为碳元素;W、Z最外层电子数相同,二者处于同一主族,Z的核电荷数是W的2倍,故Z为硫元素,W为氧元素;Y是地壳中含量最多的金属元素,则Y为Al元素,据此进行解答.
解答:
解:Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色,则X为Na元素;Q元素的原子最外层电子数是其内层电子数的2倍,Q元素原子有2个电子层,最外层电子数为4,故Q为C元素;W、Z最外层电子数相同,二者处于同一主族,Z的核电荷数是W的2倍,故Z为S元素,W为O元素;Y是地壳中含量最多的金属元素,则Y为Al元素,
A.X的单质为金属钠、Y的单质为铝,工业上通过电解熔融氯化钠制备Na,电解熔融氧化铝冶炼Al,故A正确;
B.Q为C、Z为S,则QZ2为CS2,CS2属于共价化合物,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>C>O,即r(X)>r(Y)>r(Q)>r(W),故C错误;
D.X为Na,最高价氧化物对应的水化物为NaOH,Y为Al,最高价氧化物对应的水化物为氢氧化铝,氢氧化铝是两性氢氧化物,溶于强碱,能够与氢氧化钠反应生成偏铝酸钠、水,故D正确;
故选C.
A.X的单质为金属钠、Y的单质为铝,工业上通过电解熔融氯化钠制备Na,电解熔融氧化铝冶炼Al,故A正确;
B.Q为C、Z为S,则QZ2为CS2,CS2属于共价化合物,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>C>O,即r(X)>r(Y)>r(Q)>r(W),故C错误;
D.X为Na,最高价氧化物对应的水化物为NaOH,Y为Al,最高价氧化物对应的水化物为氢氧化铝,氢氧化铝是两性氢氧化物,溶于强碱,能够与氢氧化钠反应生成偏铝酸钠、水,故D正确;
故选C.
点评:本题考查位置、结构、性质的关系及应用,题目难度中等,正确推断各元素名称是解答本题的关键,注意熟悉元素化合物的性质、物质的组成和结构等知识,试题综合性较强,有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
中学化学中很多“规律”都有其使用范围,据有关“规律”下列推论合理的是( )
| A、根据较强酸可以制取较弱酸的规律,漂白粉溶液中通入过量的SO2的反应原理:ClO-+SO2+H2O═HSO3-+HClO | ||||
B、根据金属镁可以通过电解MgCl2制得,则工业制铝原理:2AlCl3
| ||||
| C、根据FeBr2溶液中通入少量Cl2使溶液变黄,则FeI2溶液中通入少量Cl2的离子方程式为:2Fe2++Cl2═2Fe3++2Cl- | ||||
| D、MgCl2中通足量氨水,有白色沉淀生成,则AlCl3中通足量氨水的离子方程式为:Al3++3NH3?H2O═Al(OH)3+3NH4+ |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如下图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的( )
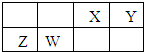

| A、Y元素最高价氧化物对应的水化物化学式为H3YO4 |
| B、原子半径由小到大的顺序为:X<Z<Y<W |
| C、与同浓度的盐酸反应,Z比W更剧烈 |
| D、W的金属性比Z的强 |
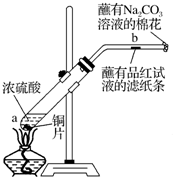 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答: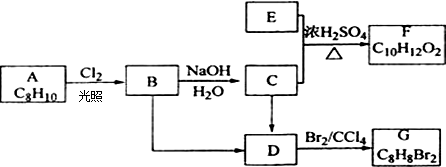
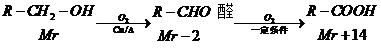
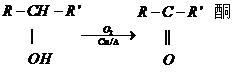 (酮中R、R′代表烃基且酮不能再被氧化为羧酸,其它物质中R、R′代表烃基或氢原子)
(酮中R、R′代表烃基且酮不能再被氧化为羧酸,其它物质中R、R′代表烃基或氢原子)