题目内容
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程的有关问题.
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式: .
(2)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式 .
(3)下列哪个装置可防止铁棒被腐蚀 .

(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
(2)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式
(3)下列哪个装置可防止铁棒被腐蚀

考点:金属冶炼的一般原理,金属的电化学腐蚀与防护
专题:电化学专题,元素及其化合物
分析:(1)一氧化碳具有还原性可以还原氧化铁生成铁和二氧化碳;
(2)氧化铁可以和盐酸之间反应生成氯化铁和水,金属铁可以和氯化铁之间反应得到氯化亚铁;
(3)根据金属生锈的条件以及原电池和电解池的工作原理知识来回答判断;
(2)氧化铁可以和盐酸之间反应生成氯化铁和水,金属铁可以和氯化铁之间反应得到氯化亚铁;
(3)根据金属生锈的条件以及原电池和电解池的工作原理知识来回答判断;
解答:
解:(1)一氧化碳具有还原性,一氧化碳可以还原氧化铁生成铁和二氧化碳,化学方程为:3CO+Fe2O3
3CO2+2Fe;
故答案为:3CO+Fe2O3
3CO2+2Fe;
(2)氧化铁可以和盐酸之间反应生成氯化铁和水,当铁锈除净后,金属铁可以和氯化铁之间反应得到氯化亚铁,即2FeCl3+Fe=3FeCl2,
故答案为:2FeCl3+Fe=3FeCl2;
(3)B装置中,金属铁做原电池的正极,被保护,不易生锈,D装置中,金属铁作阴极,被保护起来,C装置具备金属生锈的条件,A装置中,金属铁是原电池的负极,易被腐蚀,
故答案为:BD;
| ||
故答案为:3CO+Fe2O3
| ||
(2)氧化铁可以和盐酸之间反应生成氯化铁和水,当铁锈除净后,金属铁可以和氯化铁之间反应得到氯化亚铁,即2FeCl3+Fe=3FeCl2,
故答案为:2FeCl3+Fe=3FeCl2;
(3)B装置中,金属铁做原电池的正极,被保护,不易生锈,D装置中,金属铁作阴极,被保护起来,C装置具备金属生锈的条件,A装置中,金属铁是原电池的负极,易被腐蚀,
故答案为:BD;
点评:本题考查原电池和电解池的工作原理以及金属的腐蚀和防护知识,注意知识的归纳和整理是解题关键,题目难度不大.

练习册系列答案
相关题目
日常生活中,常用明矾净化生活用水,明矾在净水过程中所起的作用是( )
| A、消毒 | B、沉降 | C、软化 | D、杀菌 |
下列各组离子在指定溶液中一定能大量共存的是( )
| A、25℃时,PH=12的无色溶液:K+、Br-、SO32-、SiO32- |
| B、与铝粉反应放出极气的溶液:HCO3-、K+、Na+、SO42- |
| C、使石蕊溶液撇红色的溶液:Na+、NH4-、Cl-、S2O32- |
| D、25℃时,由水电离出来的c(H+)=1×10-13mol/L的溶液:Ba2+、Cl-、AlO2-、NO3- |
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙的气态化合物的水溶液呈碱性,甲与丙同主族,丁元素原子最外层电子数与其电子层数相等.下列说法正确的是( )
| A、原子半径:丁>丙>甲 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物为共价化合物 |
| D、乙、丙、丁的最高价氧化物对应的水化物相互反应 |
图象是一种简洁表示化学变化过程的方法,下列相关反应的图象中错误的是( )
A、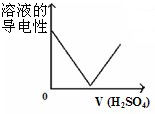 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 |
B、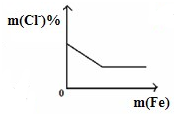 将铁粉加入到一定量FeCl3溶液中 将铁粉加入到一定量FeCl3溶液中 |
C、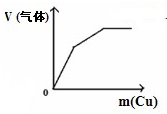 将铜粉加入到一定量浓硝酸中 将铜粉加入到一定量浓硝酸中 |
D、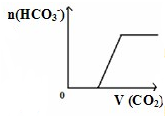 将二氧化碳通入到一定量漂粉精溶液中 将二氧化碳通入到一定量漂粉精溶液中 |
 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分: