题目内容
下列各组离子在指定溶液中一定能大量共存的是( )
| A、25℃时,PH=12的无色溶液:K+、Br-、SO32-、SiO32- |
| B、与铝粉反应放出极气的溶液:HCO3-、K+、Na+、SO42- |
| C、使石蕊溶液撇红色的溶液:Na+、NH4-、Cl-、S2O32- |
| D、25℃时,由水电离出来的c(H+)=1×10-13mol/L的溶液:Ba2+、Cl-、AlO2-、NO3- |
考点:离子共存问题
专题:离子反应专题
分析:A.25℃时,pH=12的无色溶液为碱性溶液,K+、Br-、SO32-、SiO32-离子之间不发生反应,也不与氢氧根离子反应;
B.与铝粉反应放出极气的溶液为酸性或者碱性溶液,溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子能够与氢离子和氢氧根离子反应;
C.使石蕊溶液撇红色的溶液为酸性溶液,溶液中存在大量氢离子,S2O32-离子与氢离子反应生成硫单质和二氧化硫气体;-
D.由水电离出来的c(H+)=1×10-13mol/L的溶液为酸性或者碱性溶液,溶液中存在大量氢离子或氢氧根离子,偏铝酸根离子能够与氢离子反应.
B.与铝粉反应放出极气的溶液为酸性或者碱性溶液,溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子能够与氢离子和氢氧根离子反应;
C.使石蕊溶液撇红色的溶液为酸性溶液,溶液中存在大量氢离子,S2O32-离子与氢离子反应生成硫单质和二氧化硫气体;-
D.由水电离出来的c(H+)=1×10-13mol/L的溶液为酸性或者碱性溶液,溶液中存在大量氢离子或氢氧根离子,偏铝酸根离子能够与氢离子反应.
解答:
解:A.25℃时,pH=12的无色溶液中存在大量氢氧根离子,K+、Br-、SO32-、SiO32-离子之间不反应,且都不与氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.与铝粉反应放出极气的溶液中存在大量H+或OH-,HCO3-与H+和OH-发生反应,在溶液中一定不能大量共存,故B错误;
C.使石蕊溶液撇红色的溶液为酸性溶液,S2O32-离子与氢离子反应生成硫单质和二氧化硫,在溶液中不能大量共存,故C错误;
D.由水电离出来的c(H+)=1×10-13mol/L的溶液为酸性或碱性溶液,AlO2-与酸溶液反应,在溶液中不能大量共存,故D错误;
故选A.
B.与铝粉反应放出极气的溶液中存在大量H+或OH-,HCO3-与H+和OH-发生反应,在溶液中一定不能大量共存,故B错误;
C.使石蕊溶液撇红色的溶液为酸性溶液,S2O32-离子与氢离子反应生成硫单质和二氧化硫,在溶液中不能大量共存,故C错误;
D.由水电离出来的c(H+)=1×10-13mol/L的溶液为酸性或碱性溶液,AlO2-与酸溶液反应,在溶液中不能大量共存,故D错误;
故选A.
点评:本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式正确的是( )
| A、将氨水滴入到FeCl3溶液中Fe3++3OH-═Fe(OH)3↓ |
| B、氧化铁与盐酸反应Fe2O3+6H+═2Fe3++3H2O |
| C、向FeCl3溶液中加入铁粉Fe+Fe3+═2Fe2+ |
| D、向氯化亚铁溶液中通入Cl2Fe2++Cl2═Fe3++2Cl- |
下列说法正确的是( )
| A、蛋白质溶液中加入食盐会出现白色沉淀 |
| B、目前世界上最重要的矿物燃料是乙醇 |
| C、葡萄糖在人体内氧化分解属于吸热反应 |
| D、化学反应中的能量变化,只表现为热量的变化 |
下列化学反应属于吸热反应的是( )
| A、碘的升华 |
| B、生石灰溶于水 |
| C、镁和稀硫酸反应 |
| D、木炭和二氧化碳反应 |
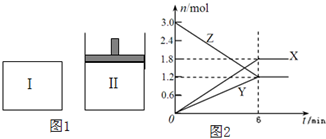 如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )
如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z=3X+2Y |
| B、若两容器中均达到平衡时,则容器Ⅱ达到平衡所需时间大于t0 |
| C、容器Ⅰ中,第5min时Z的消耗速率大于X的消耗速率 |
| D、容器Ⅰ中,前6min内Z的反应速率为0.3mol/(L?min) |
