题目内容
 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:(1)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的
(2)通过元素周期表,我们可以知道:
①氮元素的最低化合价为
②原子半径:r(P)
③在上表所列元素的最高价氧化物对应水化物中酸性最强的是
④Cl的非金属性
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)同一周期元素,原子核外电子层数相等,同一主族元素,原子最外层电子数相等,主族元素中,原子最外层电子数等于其族序数;
(2)①主族元素中元素最低化合价=族序数-8,N元素位于第VA族,N原子和3个H原子形成3个N-H键,且N原子还有一个孤电子对;
②同一周期元素,原子半径随着原子序数增大而减小;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;硝酸是强酸,在水溶液里完全电离生成氢离子和硝酸根离子;
④同一主族元素,元素的非金属性随着原子序数增大而减弱,氯气和溴化钠反应生成氯化钠和溴.
(2)①主族元素中元素最低化合价=族序数-8,N元素位于第VA族,N原子和3个H原子形成3个N-H键,且N原子还有一个孤电子对;
②同一周期元素,原子半径随着原子序数增大而减小;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;硝酸是强酸,在水溶液里完全电离生成氢离子和硝酸根离子;
④同一主族元素,元素的非金属性随着原子序数增大而减弱,氯气和溴化钠反应生成氯化钠和溴.
解答:
解:(1)同一周期元素,原子核外电子层数相等,同一主族元素,原子最外层电子数相等,主族元素中,原子最外层电子数等于其族序数,所以C、N、O、F四种元素处于同一行,是由于它们的原子核外电子层数相同,处于同一列的N和P位于元素周期表的第VA族,故答案为:原子核外电子层数;VA;
(2)①主族元素中元素最低化合价=族序数-8,N元素位于第VA族,所以N元素最低化合价为-3价,N原子和3个H原子形成3个N-H键,且N原子还有一个孤电子对,其结构式为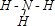 ,故答案为:-3;
,故答案为:-3;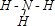 ;
;
②同一周期元素,原子半径随着原子序数增大而减小,S原子序数大于P,所以原子半径:P>S,故答案为:>;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,所以其次非金属性最强的是Cl元素,其最高价氧化物的水化物HClO4的酸性最强;硝酸是强酸,在水溶液里完全电离生成氢离子和硝酸根离子,硝酸的电离方程式为:HNO3=H++NO3-,故答案为:HClO4;HNO3=H++NO3-;
④同一主族元素,元素的非金属性随着原子序数增大而减弱,所以Cl元素的非金属性强于Br元素,氯气和溴化钠反应生成氯化钠和溴,其转移电子方向和数目为为: ,
,
故答案为:强于; .
.
(2)①主族元素中元素最低化合价=族序数-8,N元素位于第VA族,所以N元素最低化合价为-3价,N原子和3个H原子形成3个N-H键,且N原子还有一个孤电子对,其结构式为
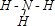 ,故答案为:-3;
,故答案为:-3;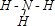 ;
;②同一周期元素,原子半径随着原子序数增大而减小,S原子序数大于P,所以原子半径:P>S,故答案为:>;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,所以其次非金属性最强的是Cl元素,其最高价氧化物的水化物HClO4的酸性最强;硝酸是强酸,在水溶液里完全电离生成氢离子和硝酸根离子,硝酸的电离方程式为:HNO3=H++NO3-,故答案为:HClO4;HNO3=H++NO3-;
④同一主族元素,元素的非金属性随着原子序数增大而减弱,所以Cl元素的非金属性强于Br元素,氯气和溴化钠反应生成氯化钠和溴,其转移电子方向和数目为为:
 ,
,故答案为:强于;
 .
.
点评:本题考查元素周期表和元素周期律的综合应用,侧重考查物质结构、元素周期律、物质性质等知识点,综合性较强,要熟练掌握基本概念、基本理论,灵活运用知识解答问题,难点是标电子转移方向和数目,题目难度不大.

练习册系列答案
相关题目
目前利用废弃塑料的基本方法有( )
①加热熔融或粉碎后,直接用做生产新产品的材料;
②加热分裂成小分子物质,小分子物质又可循环再用于制造新的塑料;
③催化裂解可以制得柴油、煤油、汽油及可燃气体.其中涉及化学变化的有.
①加热熔融或粉碎后,直接用做生产新产品的材料;
②加热分裂成小分子物质,小分子物质又可循环再用于制造新的塑料;
③催化裂解可以制得柴油、煤油、汽油及可燃气体.其中涉及化学变化的有.
| A、①和② | B、②和③ |
| C、①和③ | D、只有③ |
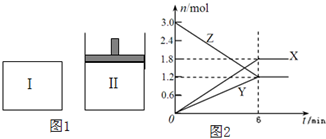 如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )
如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z=3X+2Y |
| B、若两容器中均达到平衡时,则容器Ⅱ达到平衡所需时间大于t0 |
| C、容器Ⅰ中,第5min时Z的消耗速率大于X的消耗速率 |
| D、容器Ⅰ中,前6min内Z的反应速率为0.3mol/(L?min) |

 (1)已知在25℃时:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol
(1)已知在25℃时:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol