题目内容
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,11.2L CHCl3含有的原子总数为2.5NA | |
| B. | 25g质量分数为68%的H2O2溶液中含有氧原子数目为NA | |
| C. | 高温下,16.8gFe与足量水蒸气完全反应失去0.8NA个电子 | |
| D. | 1molCH5+中含有的电子数目为11NA |
分析 A.三氯甲烷标况下为液体;
B.过氧化氢溶液中过氧化氢、水分子都含有氧原子;
C.铁与水蒸气反应生成四氧化三铁,方程式:3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,结合元素化合价变化判断;
D.1个CH5+含有10个电子.
解答 解:A.气体摩尔体积使用对象为气体,三氯甲烷标况下为液体,不能使用气体摩尔体积,故A错误;
B.过氧化氢溶液中过氧化氢、水分子都含有氧原子,所以25g质量分烽为68%的H2O2溶液中含有氧原子数目远远大于NA,故B错误;
C.依据方程式:3Fe+4H2O $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,3mol铁与足量水蒸气失去8mol电子,16.8gFe物质的量$\frac{16.8g}{56g/mol}$=0.3mol,所以16.8gFe与足量水蒸气完全反应失去0.8NA个电子,故C正确;
D.1个CH5+含有10个电子,则1molCH5+含有10mol电子,个数为:10NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大,注意气体摩尔体积使用条件和对象.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
13.某体积可变的密闭容器,盛有适量的A、B混合气体,在一定条件下发生反应A(g)+3B(g)?2C(g).若维持温度和压强不变,当反应达到限度时容器的体积为VL,其中C气体的体积分数占10%.下列推断正确的是( )
| A. | 原混合气体的体积为1.1VL | |
| B. | 原混合气体的体积为1.2VL | |
| C. | 反应达到限度时,气体A消耗掉0.05 VL | |
| D. | 反应达到限度时,气体B消耗掉0.05 VL |
14.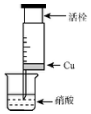 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.
(1)甲组同学设计如图装置来证实稀稍酸与铜反应,步骤如下.
A.检验50ml针筒的气密性.
B.抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后针头朝上倒放,推活栓,使针头内充满水.
C.将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住.
回答以下相关问题:
①一段时间后在针筒内观察到溶液颜色为蓝色,有无色气体产生.该反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
②反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是往针筒内抽气,气体由无色变红棕色.
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如表:
根据乙组同学三组对比实验回答问题:
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?不同意(填“同意”或“不同意”),原因是相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同.结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.为了验证推断是否正确,三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生.认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议.请分析原因过量的硝酸分解会产生红棕色的NO2.
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色.请用方程式表示溶液颜色变化的反应原理4NO2+O2+2H2O=4HNO3.
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色.
③从环保的角度看,你认为三个方案中最好的是哪一个方案二.
 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.(1)甲组同学设计如图装置来证实稀稍酸与铜反应,步骤如下.
A.检验50ml针筒的气密性.
B.抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后针头朝上倒放,推活栓,使针头内充满水.
C.将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住.
回答以下相关问题:
①一段时间后在针筒内观察到溶液颜色为蓝色,有无色气体产生.该反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
②反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是往针筒内抽气,气体由无色变红棕色.
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如表:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?不同意(填“同意”或“不同意”),原因是相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同.结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.为了验证推断是否正确,三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生.认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议.请分析原因过量的硝酸分解会产生红棕色的NO2.
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色.请用方程式表示溶液颜色变化的反应原理4NO2+O2+2H2O=4HNO3.
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色.
③从环保的角度看,你认为三个方案中最好的是哪一个方案二.
11.a、b、c是同周期的三种短周期元素.a的原子结构示意图为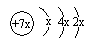 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为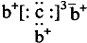 ,下列比较中正确的是( )
,下列比较中正确的是( )
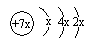 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为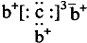 ,下列比较中正确的是( )
,下列比较中正确的是( )| A. | 原子半径:a>b>c | B. | 非金属性:a>c | ||
| C. | 氢化物的稳定性:c>a | D. | 最高价含氧酸的酸性:c>a |
18.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液.下列说法正确的是( )
| A. | 电子从K2FeO4电极沿导线移向Zn电极 | |
| B. | 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |
8.以下分离提纯操作能达到相应目的是( )
| 选项 | 操作 | 目的 |
| A | 蒸馏 | 分离氯化钠和硝酸钾混合溶液 |
| B | 分液 | 分离乙酸与乙酸乙酯混合物 |
| C | 洗气 | 通入小苏打溶液中除去CO2中的HCl气体 |
| D | 用乙醇作萃取剂 | 提取溴水中的溴单质 |
| A. | A | B. | B | C. | C | D. | D |

 bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则