题目内容
14. 某研究性学习小组设计不同实验方案来研究硝酸的性质.
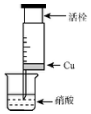
某研究性学习小组设计不同实验方案来研究硝酸的性质.(1)甲组同学设计如图装置来证实稀稍酸与铜反应,步骤如下.
A.检验50ml针筒的气密性.
B.抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后针头朝上倒放,推活栓,使针头内充满水.
C.将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住.
回答以下相关问题:
①一段时间后在针筒内观察到溶液颜色为蓝色,有无色气体产生.该反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
②反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是往针筒内抽气,气体由无色变红棕色.
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如表:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?不同意(填“同意”或“不同意”),原因是相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同.结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.为了验证推断是否正确,三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生.认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议.请分析原因过量的硝酸分解会产生红棕色的NO2.
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色.请用方程式表示溶液颜色变化的反应原理4NO2+O2+2H2O=4HNO3.
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色.
③从环保的角度看,你认为三个方案中最好的是哪一个方案二.
分析 (1)硝酸具有强氧化性,能氧化单质铜生成硝酸铜,溶液呈蓝色,要验证NO,可利用其极易被氧气氧化生成红棕色二氧化氮来实现;
(2)因为反应中硝酸过量,而铜的质量也是相等的,即生成的硝酸铜的浓度是相同的,说以不可能是因为浓度差异引起,由于硝酸过量,而硝酸是不稳定的,在加热的条件下,硝酸也会分解生成二氧化氮,在氧气的作用下,生成硝酸,由于消耗了二氧化氮,所以溶液颜色显蓝色,根据原理可知方案1和3均引起环境污染,说以方案2是最好的.
解答 解:(1)①硝酸具有强氧化性,与铜反应生成硝酸铜,稀硝酸生成NO,NO气体无色,化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
故答案为:无;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
②要验证NO,可利用其极易被氧气氧化生成红棕色二氧化氮来实现,方法是往针筒内抽气,气体由无色变红棕色;
故答案为:往针筒内抽气,气体由无色变红棕色;
(2)①因为反应中硝酸过量,而铜的质量也是相等的,即生成的硝酸铜的浓度是相同的;
故答案为:不同意;相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同;
②硝酸是不稳定的,在加热的条件下,硝酸也会分解生成二氧化氮,二氧化氮和与氧气反应生成硝酸,反应的方程式为4NO2+O2+2H2O=4HNO3;
故答案为:过量的硝酸分解会产生红棕色的NO2;4NO2+O2+2H2O=4HNO3;
③方案一和三均引起环境污染,说以方案二是最好的;
故答案为:方案二.
点评 本题考查了铜与硝酸的反应,综合考查学生实验设计和探究能力,涉及硝酸的性质、物质验证性实验设计,利用对比的方法判断硝酸的性质,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 使用滴定管前要检查是否漏液 | |
| B. | 用简易量热计测定反应热时,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应,以达到良好的实验效果 | |
| C. | 用精密pH试纸测得某浓度氯水的pH为3.5 | |
| D. | 燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③水分子稳定性好是因水分子间含有氢键
④非金属单质中一定存在共价键
⑤由非金属元素组成的化合物一定是共价化合物
⑥化学反应中一定有化学键断裂,同时也有化学键形成
⑦盐酸中含有H+和Cl-,所以HCl是离子化合物( )
| A. | ①③⑥⑦ | B. | ①②④③⑥ | C. | ①⑥⑦ | D. | ①⑥ |
| A. | 1:2 | B. | 2:3 | C. | 3:1 | D. | 3:2 |
| A. | 标准状况下,11.2L CHCl3含有的原子总数为2.5NA | |
| B. | 25g质量分数为68%的H2O2溶液中含有氧原子数目为NA | |
| C. | 高温下,16.8gFe与足量水蒸气完全反应失去0.8NA个电子 | |
| D. | 1molCH5+中含有的电子数目为11NA |