题目内容
15.下列四种物质:Cu粉、澄清石灰水、Na2CO3溶液、稀硫酸两两混合后,将发生的离子反应有( )| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 据铜粉、澄清石灰水石灰水、Na2CO3溶液、稀硫酸的性质进行分析,两两混合后只要满足离子反应发生的条件:生成沉淀、气体或弱电解质,则反应能够进行,据此进行判断.
解答 解:满足离子反应发生的条件,能够反应离子反应,
Cu粉的还原性较弱,不与其它物质反应;
澄清石灰水的主要成分为氢氧化钙,氢氧化钙能够与Na2CO3溶液生成碳酸钙沉淀;氢氧化钙与稀硫酸反应生成硫酸钙和水;
Na2CO3溶液能够与稀硫酸反应生成硫酸钠、二氧化碳和水,
所以能够发生的离子反应有3个,
故选C.
点评 本题考查了离子反应条件及应用,题目难度不大,要求学生熟练掌握离子反应发生的条件,可以依据物质的性质结合已有的知识完成,试题培养了学生的灵活应用能力.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
5.(1)自来水厂可以用氯气来杀菌、消毒,则氯气与水反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,此反应中氧化产物是HClO.
(2)老师在课堂上演示了一个趣味实验:把一块湿润的有色布条放到盛有干燥氯气的集气
瓶中.有色布条很快变成“白色”布条.学生对此进行了猜测.
猜测一:氯气具有漂白性,能使有色布条褪色
猜测二:氯气与湿润有色布条上的水分作用,产生的次氯酸使有色布条褪色.
某同学设计如下实验装置,验证猜想是否正确:
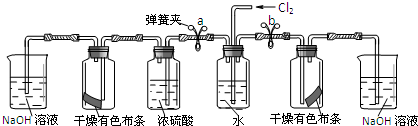
I.将预期的实验现象和结论填在下表中.
Ⅱ.该装置左右两边均设计了盛有氢氧化钠溶液的吸收装置,作用是吸收多余的尾气,以免氯气污染空气.
(2)老师在课堂上演示了一个趣味实验:把一块湿润的有色布条放到盛有干燥氯气的集气
瓶中.有色布条很快变成“白色”布条.学生对此进行了猜测.
猜测一:氯气具有漂白性,能使有色布条褪色
猜测二:氯气与湿润有色布条上的水分作用,产生的次氯酸使有色布条褪色.
某同学设计如下实验装置,验证猜想是否正确:

I.将预期的实验现象和结论填在下表中.
| 步骤 | 实验操作 | 预期现象和结论 |
| ① | 松开a处弹簧夹,夹上b处弹簧夹 | 装置左边集气瓶中的有色布条不褪色 删去,证明猜想一不正确. |
| ② | 松开b处弹簧夹,夹上a处弹簧夹 | 装置右边集气瓶中的有色布条褪色, 说明猜想二正确. |
3.用NA表示阿伏加德罗常数的值.下列叙述中错误的是( )
| A. | 分子总数为NA的NO2和CO2混合气体含有的氧原子数为2NA | |
| B. | 含有NA个原子的氢气在标准状况下的体积约为11.2 L | |
| C. | 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 40 g NaOH溶解在1 L水中,所制得的100 mL溶液中含Na+数为0.1 NA |
10.下列叙述正确的是( )
| A. | 硫酸钡难溶于水,在水溶液中不能导电,所以硫酸钡不是电解质 | |
| B. | 电解质的电离一定要在水分子作用下才能进行 | |
| C. | 三氧化硫溶于水能导电,所以三氧化硫是电解质 | |
| D. | 硫酸、氢氧化钡、纯碱、苛性钠都是电解质 |
5.根据化学反应的实质是旧键断裂,新键形成这一观点,下列变化不属于化学反应的是( )
| A. | 干冰气化 | B. | O2转变成O3 | C. | 加热NH4HCO3 | D. | 加热NaHCO3 |