题目内容
11.下列各元素的氧化物中,既能与盐酸反应,又能与NaOH溶液反应的是( )| A. | 元素X:它的原子中第三电子层比第二电子层少2个电子 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| C. | 元素Z:位于元素周期表中的第3周期,ⅢA族 | |
| D. | 元素W:它的单质硬度最大 |
分析 结合结构特征,分别判断出X、Y、Z、W是何种元素,它们形成的氧化物分属于那类物质,再根据物质的类别通性进行判断,氧化物中,既能与盐酸反应生成盐和水,又能够与 NaOH 溶液反应生成盐和水的是两性氧化物的性质.
解答 解:A、元素X为硫元素,形成的氧化物二氧化硫、三氧化硫是酸性氧化物,只能与碱反应生成盐和水,故A不符合;
B、元素Y为钙元素,形成的氧化物CaO为碱性氧化物,只能和酸反应生成盐和水,故B不符合;
C、元素Z为铝,形成的氧化物Al2O3是两性氧化物,能和强酸强碱反应生成盐和水,故C符合;
D、元素W:它的单质硬度最大是碳,氧化物为二氧化碳,只能与碱反应生成盐和水,故D不符合;
故选C.
点评 本题考查了原子结构的应用,元素性质焰色反应的运用,氧化物的化学性质,重点是铝的氧化物性质的应用.

练习册系列答案
相关题目
1.下列各组顺序不正确的是( )
| A. | 微粒半径大小:S2->Cl->F->Na+>Al3+ | |
| B. | 热稳定性大小:SiH4<PH3<NH3<H2O<HF | |
| C. | 熔点高低:金刚石>石墨>食盐>干冰>碘晶体 | |
| D. | 沸点高低:NH3>AsH3>PH3 |
19.下列叙述中正确的是( )
| A. | 只含离子键的化合物才是离子晶体 | |
| B. | (NH4)2SO4晶体是含有离子建、共价键和配位键的分子晶体 | |
| C. | 由于I-I中的共价键键比F-F、Cl-Cl、Br-Br都弱,因此在卤素单质中I2的熔点、沸点最低 | |
| D. | 分子晶体中一定不存在离子键,而离子晶体中可能存在共价键 |
6.以下性质的比较中,不正确的是( )
| A. | 晶格能 NaCl<MgO | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 离子半径:Na+<O2- | D. | 第一电离能:P>Cl>S |
16.a g下列物质在氧气中充分燃烧后的气体(1.01×105Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有( )
| A. | HCHO | B. | CH3COOCH2CH3 | C. | HOOCCOOH | D. | CH3COOH |
3.下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(6)小题按题目要求回答.
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF
(4)在B、C、E、F、G、H中,原子半径最大的是Na
(5)A和D组成化合物的电子式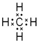
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式2OH-+Al2O3=2AlO2-+H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF
(4)在B、C、E、F、G、H中,原子半径最大的是Na
(5)A和D组成化合物的电子式

(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式2OH-+Al2O3=2AlO2-+H2O.
1.下列反应的离子方程式正确的是( )
| A. | 硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-═Fe2S3 | |
| C. | 过量的铁与稀硝酸溶液:3Fe+8H++2NO3-═3Fe2++4H2O+2NO? | |
| D. | 铁粉放入氯化铁溶液:Fe+Fe3+═Fe2+ |