题目内容
1.下列反应的离子方程式正确的是( )| A. | 硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-═Fe2S3 | |
| C. | 过量的铁与稀硝酸溶液:3Fe+8H++2NO3-═3Fe2++4H2O+2NO? | |
| D. | 铁粉放入氯化铁溶液:Fe+Fe3+═Fe2+ |
分析 A.漏掉硫酸根离子与钡离子的反应;
B.Fe3+与S2-发生氧化还原反应生成二价铁离子和硫单质;
C.反应中无气体放出,说明NO3-被还原为NH4+;
D.电荷不守恒.
解答 解:A.离子方程式中缺少硫酸根离子和钡离子反应生成硫酸钡,正确的离子方程式为:3SO42-+3Ba2++2Fe3++6OH-═3BaSO4↓+2Fe(OH)3↓,故A错误;
B.Fe3+与S2-发生氧化还原反应,正确的离子方程式为2Fe3++S2-═2Fe2++S↓,故B错误;
C.反应中无气体放出,说明NO3-被还原为NH4+,离子方程式符合书写要求,反应的方程式为:4Fe+10H++NO3-═4Fe2++3H2O+NH4+,故C正确;
D.铁粉放入氯化铁溶液,离子方程式:Fe+2Fe3+═3Fe2+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写注意问题是解题关键,注意离子反应遵循客观事实、遵循原子个数守恒规律.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
11.下列各元素的氧化物中,既能与盐酸反应,又能与NaOH溶液反应的是( )
| A. | 元素X:它的原子中第三电子层比第二电子层少2个电子 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| C. | 元素Z:位于元素周期表中的第3周期,ⅢA族 | |
| D. | 元素W:它的单质硬度最大 |
9.如表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
.
(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)元素⑥、⑦氢化物的稳定性顺序为HCl>H2S (填写化学式);
(4)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入如表.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)元素⑥、⑦氢化物的稳定性顺序为HCl>H2S (填写化学式);
(4)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入如表.
| 实验步骤 | 实验现象 | 结论与化学反应方程式 |
16.下列关于苯的叙述中正确的是( )
| A. | 苯分子中碳碳键为单双键交替结构 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯与氢气在一定条件下反应生成环己烷 | |
| D. | 苯可以与溴水反应而使其褪色 |
6.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | 物质WY2、W3X4、WZ4均有熔点高、硬度小的特性 |
13.下列各物质中既能发生消去反应,又能被氧化为醛的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
11.下列各物质中,不能发生水解反应的是( )
| A. | 油脂 | B. | 果糖 | C. | 氨基酸 | D. | 淀粉 |
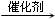
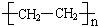 .
.