题目内容
9.将40g镁、铁、锌组成的混合物语适量的稀硫酸恰好完全反应,蒸干溶液测得固体质量136g,在上述溶液中加入一定量的氢氧化钠溶液使金属离子全部转化为沉淀,则此沉淀的质量是( )| A. | 96g | B. | 74g | C. | 82.5g | D. | 无法计算 |
分析 因为原来的40g固体是Mg,Zn,Fe单质的总质量,136g蒸干所得固体是MgSO4、FeSO4、ZnSO4的总质量,那么136g-40g=96g就是加进来的硫酸根的质量,因为硫酸根的分子量是96,所以加入的硫酸根是1mol,加入一定量的氢氧化钠溶液使金属离子全部转化为沉淀,因为1mol的硫酸根离子带2mol的负电荷,所以根据电荷守恒,金属离子结合氢氧根离子的物质的量为2mol,由此分析解答.
解答 解:因为原来的40g固体是Mg,Zn,Fe单质的总质量,136g蒸干所得固体是MgSO4、FeSO4、ZnSO4的总质量,那么136g-40g=96g就是加进来的硫酸根的质量,因为硫酸根的分子量是96,所以加入的硫酸根是1mol,加入一定量的氢氧化钠溶液使金属离子全部转化为沉淀,因为1mol的硫酸根离子带2mol的负电荷,所以根据电荷守恒,金属离子结合氢氧根离子的物质的量为2mol,所以沉淀的质量是40+2×17=74g,
故选B.
点评 本题考查混合物的计算、氧化还原反应的计算,题目难度中等,明确电子转移的数目和氢氧根离子之间的关系,为解答该题的关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 60gSiO2中含Si-O键的个数为2NA | |
| C. | 12 g石墨中含有C-C键的个数为1.5NA | |
| D. | 36 g戊烷中共价键的个数为10NA |
17.用括号中的试剂除去各组中的杂质,正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 溴苯中的溴(苯) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 95.6%乙醇中的水(生石灰) |
4.Ⅰ、A~G七种元素中,除F外其他均为短周期主族元素,它们的原子结构或性质如表所示:
请回答下列问题:
(1)A在元素周期表中的位置是第二周期,第ⅣA族;F的原子结构示意图是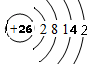 ;
;
(2)下列事实能证明C和E的非金属性强弱的是②③.(填序号)
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的稳定性强于E的气态氢化物的稳定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是NH4HCO3(填化学式),它与足量NaOH溶液在加热时反应的离子方程式为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O.
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式: ,
,
已知在25℃,101KPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40kJ,写出该氢化物燃烧热:1040kJ/mol.
Ⅱ、甲、乙、丙、丁均为上述元素所形成的物质,甲是单质,它们之间有如下的反应关系:
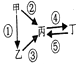
(1)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业,乙所含化学键的类型是离子键和共价键.写出乙→丙的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
(2)若丁物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写出丙→丁的离子方程式:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-.室温下,若由丁物质形成的水溶液中甲离子浓度为1.3×10-6 mol•L-1,则该溶液的pH为5.(丁的Ksp为1.3×10-33)
| 元素 | 原子结构或性质 |
| A | 其形成的一种同位素元素在考古中可推测化石的年代 |
| B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
| C | 地壳中含量最多的元素 |
| D | D原子的最外层电子数与其电子层数相同,是地壳中含量最多的金属元素 |
| E | 其单质主要存在于火山口附近 |
| F | 生活中常见的金属,它的某种氧化物均有磁性 |
| G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
(1)A在元素周期表中的位置是第二周期,第ⅣA族;F的原子结构示意图是
 ;
;(2)下列事实能证明C和E的非金属性强弱的是②③.(填序号)
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的稳定性强于E的气态氢化物的稳定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是NH4HCO3(填化学式),它与足量NaOH溶液在加热时反应的离子方程式为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O.
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式:
 ,
,已知在25℃,101KPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40kJ,写出该氢化物燃烧热:1040kJ/mol.
Ⅱ、甲、乙、丙、丁均为上述元素所形成的物质,甲是单质,它们之间有如下的反应关系:

(1)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业,乙所含化学键的类型是离子键和共价键.写出乙→丙的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
(2)若丁物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写出丙→丁的离子方程式:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-.室温下,若由丁物质形成的水溶液中甲离子浓度为1.3×10-6 mol•L-1,则该溶液的pH为5.(丁的Ksp为1.3×10-33)
14.下列实验操作能达到预期实验目的是( )
| 实验目的 | 实验操作 | |
| A | 检验FeCl3溶液的Fe2+ | 向溶液中加入酸性KMnO4溶液 |
| B | 比较CH3COOH和HCN的酸性强弱 | 用pH计分别测定CH3COONa、NaCN饱和溶液的pH |
| C | 制备H2SiO3胶体 | 向Na2SiO3溶液中滴加过量HCl |
| D | 除去乙酸乙酯中的CH3COOH | 加入饱和Na2CO3溶液,振荡后静置,分液 |
| A. | A | B. | B | C. | C | D. | D |
6.在标准状况下,将O2和NO2按1:4的体积比充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液里溶质的物质的量浓度为( )
| A. | $\frac{1}{14}$ mol•L-1 | B. | $\frac{4}{5}$ mol•L-1 | C. | $\frac{1}{28}$ mol•L-1 | D. | $\frac{1}{42}$ mol•L-1 |
4.实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4.FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如图1:
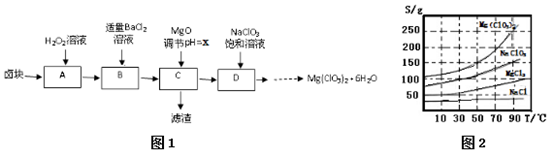
已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图2所示.
②室温时一些物质的Ksp如表:
③Mg(ClO3)2有较强的氧化性,其还原产物是Cl-.
(1)H2O2的电子式为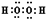
(2)滤渣的成分是Fe(OH)3、BaSO4(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为3.3
(4)D中所发生的化学反应方程式式为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,框图中由D→…→制Mg(ClO3)2•6H2O晶体的实验步骤依次为:①加热蒸发;②趁热过滤(请补充);③冷却结晶;④过滤洗涤.
(5)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10.00mL试液于锥形瓶中,加入10.00mL稀硫酸和20.00mL 1.000mol/L的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点.
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果偏小(填“偏大”.“偏小”或“不变”).
③若平均消耗K2Cr2O7溶液15.00mL,则产品中Mg(ClO3)2•6H2O(其M=299g/mol)的质量分数为78.3%.

已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图2所示.
②室温时一些物质的Ksp如表:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
(1)H2O2的电子式为
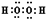
(2)滤渣的成分是Fe(OH)3、BaSO4(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为3.3
(4)D中所发生的化学反应方程式式为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,框图中由D→…→制Mg(ClO3)2•6H2O晶体的实验步骤依次为:①加热蒸发;②趁热过滤(请补充);③冷却结晶;④过滤洗涤.
(5)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10.00mL试液于锥形瓶中,加入10.00mL稀硫酸和20.00mL 1.000mol/L的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点.
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果偏小(填“偏大”.“偏小”或“不变”).
③若平均消耗K2Cr2O7溶液15.00mL,则产品中Mg(ClO3)2•6H2O(其M=299g/mol)的质量分数为78.3%.
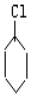 $→_{②}^{NaOH、乙醇}$
$→_{②}^{NaOH、乙醇}$ $→_{③}^{溴的CCl_{4}溶液}$B$\stackrel{④}{→}$
$→_{③}^{溴的CCl_{4}溶液}$B$\stackrel{④}{→}$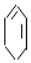

 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.