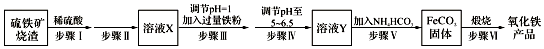题目内容
1.下列有关说法正确的是( )| A. | 用pH试纸测得NaC1O溶液的pH为10 | |
| B. | 用澄清石灰水鉴别Na2CO3溶液与NaHCO3溶液 | |
| C. | 向Fe(NO3)2溶液中滴加稀盐酸,无明显现象 | |
| D. | 向K2Cr2O7溶液中滴加NaOH溶液,溶液逐渐变黄 |
分析 A、NaClO溶液有漂白性;
B、碳酸钠、碳酸氢钠均能与石灰水反应生成碳酸钙沉淀;
C、向Fe(NO3)2溶液中滴加稀盐酸,即会存在硝酸,能将亚铁离子氧化为铁离子;
D、在水溶液中,重铬酸钾K2Cr2O7存在以下平衡Cr2O72-+H2O?2CrO42-+2H+.
解答 解:A、NaClO溶液有漂白性,故不能用pH试纸来测其pH,故A错误;
B、碳酸钠、碳酸氢钠均能与石灰水反应生成碳酸钙沉淀,故不能用石灰水来鉴别碳酸钠和碳酸氢钠,故B错误;
C、向Fe(NO3)2溶液中滴加稀盐酸,即会存在硝酸,能将亚铁离子氧化为铁离子,硝酸被还原为NO气体,故加入盐酸后有气体生成,且溶液由浅绿色变为棕黄色,故C错误;
D、在水溶液中,重铬酸钾K2Cr2O7存在以下平衡Cr2O72-+H2O?2CrO42-+2H+,故加入氢氧化钠溶液后,平衡右移,则溶液由橙色变为黄色,故D正确.
故选D.
点评 本题考查了化学平衡的移动和物质的鉴别以及氧化还原反应,难度不大,应注意的是向硝酸亚铁中加入稀盐酸,不能发生复分解反应,但发生了氧化还原反应.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
11.无色透明溶液中能大量共存的离子组是( )
| A. | K+、Al3+、HCO3-、NO3- | B. | AlO2-、Cl-、Mg2+、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、ClO-、I- |
12.为了提纯表所列物质(括号内为杂质),有关除杂试剂盒分离方法的选择均正确的是( )
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
16.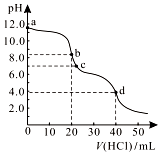 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )| A. | a点溶液呈碱性的原因用离子方程式表示为:CO32-+2H2O?H2CO3+2OH- | |
| B. | c点处的溶液中c(Na+)-c(Cl-)=c(HCO3-)+2c(CO32-) | |
| C. | 滴定过程中使用甲基橙作为指示剂比酚酞更准确 | |
| D. | d点处溶液中水电离出的c(H+)大于b点处 |
13.现有氯化钠、氯化铝、氯化铁、氯化镁四种溶液,只用一种试剂通过一步实验就能加从区别,这种试剂是
( )
( )
| A. | KSCN溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | HCl溶液 |
10.下列有关实验现象或结论的描述不正确的是( )
| A. | FeCl2溶液与K3[Fe(CN)6]混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| B. | 向饱和食盐水中加入少量浓盐酸,看到溶液振荡,溶液变浑浊 | |
| C. | 某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大 | |
| D. | 处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
4.某温度下,在恒容密闭容器中充入1molN2和3molH2,发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1达到平衡时,反应放出36.8kJ热量,则平衡时NH3的物质的量为( )
| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 2mol |