题目内容
9.工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)制备铁红(Fe2O3)的生产流程如图: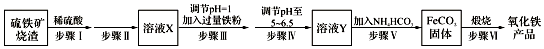
试回答下列问题:
(1)步骤Ⅰ所得溶液中铁元素的化合价是+2、+3.
(2)实验室中实现步骤Ⅱ中分离操作需要的仪器有漏斗、铁架台、玻璃棒、烧杯.
(3)步骤Ⅲ中发生的离子方程式2H++Fe=Fe2++H2↑,2Fe3++Fe=3Fe2+,向反应后的溶液中加入试剂KSCN溶液,当观察到无血红色现象说明步骤Ⅲ已经进行完全.
(4)步骤Ⅳ中不能选用试剂bc调节溶液的pH(填字母编号).
a.FeO固体 b.氢氧化钠溶液 c.Fe2O3固体 d.氨水
(5)室温下FeCO3达到溶解平衡时溶液pH=8.5,c(Fe2+)=1.2×10-6 mol•L-1.则FeCO3固体产物中无(选填“有”或“无”)Fe(OH)2.(已知:Ksp[Fe(OH)2]=4.8×10-16)
(6)步骤Ⅵ中发生反应的化学反应方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
分析 在硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)中加入稀硫酸,SiO2不与酸反应,则步骤Ⅱ为过滤除去SiO2,滤液含有二价铁、三价铁离子,步骤Ⅲ调节pH=1,再加入过量铁粉将Fe3+还原为Fe2+,步骤Ⅳ可加入氨水或者FeO调节溶液pH至5~6.5,过滤后在滤液中加入碳酸氢铵可生成FeCO3,高温煅烧可得Fe2O3,据此分析解答.
解答 解:(1)根据以上分析,步骤Ⅰ为Fe3O4、Fe2O3、FeO与硫酸反应溶解,所以所得溶液中铁元素的化合价是+2、+3;故答案为:+2、+3;
(2)根据以上分析,步骤Ⅱ为过滤,需要的仪器有漏斗、铁架台、玻璃棒、烧杯,故答案为:漏斗;
(3)步骤Ⅲ调节pH=1,再加入过量铁粉将Fe3+还原为Fe2+,因为硫酸过量,所以铁还与氢离子反应放出氢气,发生的离子方程式为2H++Fe=Fe2++H2↑,2Fe3++Fe=3Fe2+,向反应后的溶液中加入试剂KSCN溶液,当观察到无血红色现象说明步骤Ⅲ已将Fe3+完全还原为Fe2+,故答案为:2H++Fe=Fe2++H2↑,2Fe3++Fe=3Fe2+;KSCN溶液;无血红色现象;
(4)步骤Ⅳ可加入氨水或者FeO调节溶液pH至5~6.5,b碱性太强不易控制,c会引入三价铁离子,所以不能选用试剂bc调节溶液的pH;故选:bc;
(5)FeCO3达到沉淀溶解平衡时,溶液的pH为8.5,c(Fe2+)=1.2×10-6 mol•L-1时,根据氢氧化亚铁的Qc=c(Fe2+)•c2(OH-)=1.2×10-6mol•L-1×(10-5.5mol/L)2=1.2×10-17<Ksp[Fe(OH)2],所以不会出现氢氧化亚铁沉淀,
故答案为:无;
(6)步骤ⅥFeCO3高温煅烧生成Fe2O3,发生反应的化学反应方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
点评 本题考查物质的制备和分离操作,侧重于学生分析能力、实验能力和综合运用化学知识能力的考查,为高考常见题型,题目难度中等,注意根据实验流程以及相关物质的性质解答该题.

 名校课堂系列答案
名校课堂系列答案| A. | 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA | |
| B. | 3g甲酸与乙醛的混合物中含有共价键为0.4NA | |
| C. | 将标准状况下2.24LSO2通入水中完全溶解,溶液H2SO3分子数为0.1NA | |
| D. | 标准状况下8.96L的平均相对分子质量为3.5的H2与D2含有中子数0.3NA |
| A. | H2O | B. | NH3 | C. | PH3 | D. | CH4 |
| A. |  将海带灼烧灰化 | |
| B. |  铝热反应 | |
| C. |  比较Na2CO3与NaHCO3固体的热稳定性 | |
| D. |  实验室制取乙酸乙酯 |
| A. | 金属锂作电池的负极 | |
| B. | 电池正极反应为FeS2+4Li++4e-═Fe+2Li2S | |
| C. | 放电时,Li+向负极迁移 | |
| D. | 电池总反应为FeS2+4Li═Fe+2Li2S |
| A. | 用pH试纸测得NaC1O溶液的pH为10 | |
| B. | 用澄清石灰水鉴别Na2CO3溶液与NaHCO3溶液 | |
| C. | 向Fe(NO3)2溶液中滴加稀盐酸,无明显现象 | |
| D. | 向K2Cr2O7溶液中滴加NaOH溶液,溶液逐渐变黄 |
| A. | 钠在硫酸铁溶液中可置换出铁 | B. | 铜在硝酸银溶液中可置换出银 | ||
| C. | 铁不与H2O反应 | D. | 氢在空气中会自燃 |

| A. | 用图1所示装置制取少量Cl2 | B. | 用图2所示装置制取干燥的NH3 | ||
| C. | 用图3制备并检验H2的可燃性 | D. | 用图4装置鉴别碳酸钠和碳酸氢钠 |