��Ŀ����
6���������ƣ�Na2FeO4�����к�ǿ�������ԣ���һ����ɫ������ˮ����ֻ�ڼ��Ի������ȶ����ڣ�������ͨ�����������������Ʊ��������Ʋ�̽�������ʵ�ʵ�飬�������£�
I���Ʊ��������ƣ�Na2FeO4��
��1���Ʊ�NaC1O��Һ
��֪��3C12+6NaOH $\frac{\underline{\;\;��\;\;}}{\;}$5NaC1+NaC1O3+3H2O
��ͼ��װ���з�����Ӧ�����ӷ���ʽ��C12+2OH-=C1-+C1O-+H2O��
Ϊ��ֹ����NaC1O3��������ͻ���N2ϡ���⣬��Ӧ��ȡ�Ĵ�ʩ�ǽ��������䣨�����ˮԡ�У�
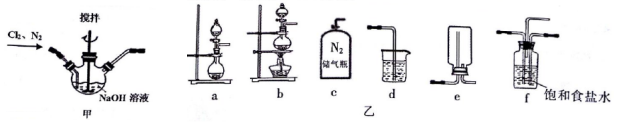
����֪ʵ������ȡCl2��ԭ����MnO2+4HC1��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnC12+C12��+2H2O��ѡ��ͼ���в���װ����ͼ��װ����ϳ�һ���Ʊ�NaC1O��װ�ã�Ӧѡ���װ����bedf ������ĸ����
��2���Ʊ�Fe2��SO4��3���������ữ��FeSO4��Һ�м���H2O2��Һ�����ܹ۲쵽����������Һ��ƣ�FeSO4��H2O2��Ӧ���������뻹ԭ�������ʵ���֮����1��2��
��3���Ʊ�Na2FeO4����Fe2��SO4��3��Һ���뵽NaOH��NaC1O�Ļ����Һ�У��䷴Ӧ�����ӷ���ʽ��3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O��
�������ƣ�Na2FeO4��������
��4����֪����ˮ1��pH������ˮ2��pH����ˮ������ɷ���ͬ����������Na2FeO4Ͷ�뵽��ˮ1����ˮ2�У���Na2FeO4��Ũ������ˮ2 �����ˮ1������ˮ2�����н��͵����ʿ죮
��5�������Na2FeO4�������ܾ���ˮ��ԭ���������������ԭ���������ӣ�������ˮ��������������������������ԣ�Na2FeO4 ��Ħ��������166g/mol��������Ч�ʣ��Ե�λ�����õ��ĵ�������ʾ����Cl2��0.64����������������λС������
���� ��1����ͼ��װ��A�ķ�ӦΪC12+2NaOH=NaC1+NaC1O+H2O�������Ӳ����뷴Ӧ�����ӷ���ʽΪ��C12+2OH-=C1-+C1O-+H2O����ֹ�¶Ƚϸ�����NaC1O3��Ҫ��Ӧ�¶Ƚϵͣ�
�ڸ��ݷ�Ӧ���е������ͺ��е�����ѡ����Ӹ���װ�÷�����
��2��˫��ˮ��������������Ϊ��ɫ�������ӣ�д����֪�������뻹ԭ��֮�ȣ�
��3����Fe2��SO4��3��Һ���뵽NaOH��NaC1O�Ļ����Һ�У�����Na2FeO4����֪��Ԫ�ػ��ϼ����߱���������������������Ԫ�أ���������Ʊ���ԭΪ�����ӣ�д����ʽ��
��4�����������ǿ���Խ������ȶ����ڣ��������Խ�����ˮ��ˮ�����������������������Ӿ�ˮ��������������ˮ�⾻ˮ��
��5����������Ч�Ȼ�ԭ���������ӣ�������ˮ��������������������������ԣ�������ͬ�����ĸ�������������ת�Ƶĵ������ɵã�
��� �⣺��1������ͼ��װ��A�ķ�ӦΪC12+2NaOH=NaC1+NaC1O+H2O�������Ӳ����뷴Ӧ�����ӷ���ʽΪ��C12+2OH-=C1-+C1O-+H2O������֪��3C12+6NaOH $\frac{\underline{\;\;��\;\;}}{\;}$5NaC1+NaC1O3+3H2O����ֹ�¶Ƚϸ�����NaC1O3��Ҫ��Ӧ�¶Ƚϵͣ���Ӧ���������䣨�����ˮԡ�У�
�ʴ�Ϊ��C12+2OH-=C1-+C1O-+H2O�����������䣨�����ˮԡ�У�
�ڷ�Ӧ��Ҫ���ȣ���ѡ��b�������л����Ȼ������壬���ñ���ʳ��ˮ���Ȼ��⣬��f�������뵪������ռ�װ����c��������Ⱦ��������������գ���d��
�ʴ�Ϊ��bcdf��
��2���������ữ��FeSO4��Һ�м���H2O2��Һ�������ķ�ӦΪ��2Fe2++H2O2+2H+�T2Fe3++2H2O�������ӵ���Һ�Ի�ɫ��˫��ˮΪ����������������Ϊ��ԭ�������������뻹ԭ��֮��Ϊ1��2��
�ʴ�Ϊ����Һ��ƣ�1��2��
��3����֪����3����Fe2��SO4��3��Һ���뵽NaOH��NaC1O�Ļ����Һ�У�����Na2FeO4����֪��Ԫ�ػ��ϼ����߱���������������������Ԫ�أ���������Ʊ���ԭΪ�����ӣ���ϼ��Ի��������������ӷ���ʽΪ��3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O��
�ʴ�Ϊ��3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O��
��4�����������ǿ���Խ������ȶ����ڣ��������Խ�����ˮ��ˮ������������ˮ�⾻ˮ��������������ˮ�⾻ˮ����ˮ2�������Դ���ˮ2�и�������Ũ�Ƚ��ͽϿ죻
�ʴ�Ϊ����ˮ2��
��5����������������ԭ���������ӣ�������ˮ��������������������������ԣ��ɾ�ˮ��
����1mol�������ƣ���������Ϊ166g��������ҲΪ166g��
���ݣ�Na2FeO4��Fe3+��3e-�����������ת�Ƶĵ�����Ϊ3mol��
����Cl2��2Cl-��2e-��
71g 2mol
166g��$\frac{166g��2mol}{71g}$=4.67mol����Na2FeO4 ����������Cl2��$\frac{3mol}{4.67mol}$=0.64��
�ʴ�Ϊ����������������ԭ���������ӣ�������ˮ��������������������������ԣ�0.64��
���� ���⿼�������ʵ��Ʊ�����飬�漰����ʽ����д��ʵ�������Ŀ��ơ������֪ʶ�㣬��Ŀ�ѶȽϴ�ע�����Ŀ��Ϣ����ȡ��

| A�� | H2O | B�� | NH3 | C�� | PH3 | D�� | CH4 |
| A�� | ���������صĸ��� | |
| B�� | ���������ӦΪFeS2+4Li++4e-�TFe+2Li2S | |
| C�� | �ŵ�ʱ��Li+��Ǩ�� | |
| D�� | ����ܷ�ӦΪFeS2+4Li�TFe+2Li2S |
| A�� | ��pH��ֽ���NaC1O��Һ��pHΪ10 | |
| B�� | �ó���ʯ��ˮ����Na2CO3��Һ��NaHCO3��Һ | |
| C�� | ��Fe��NO3��2��Һ�еμ�ϡ���ᣬ���������� | |
| D�� | ��K2Cr2O7��Һ�еμ�NaOH��Һ����Һ��� |
| A�� | 56g��������������ȼ�գ�ת�Ƶĵ�����Ϊ2NA | |
| B�� | 1g��������NA���������� | |
| C�� | ��״���£�22.4 Lˮ����1 molˮ���� | |
| D�� | 2 mol�������ϡ���ᷴӦ����NA���������� |
| A�� | ������������Һ�п��û����� | B�� | ͭ����������Һ�п��û����� | ||
| C�� | ������H2O��Ӧ | D�� | ���ڿ����л���ȼ |
| A�� | ����ˮ�м���NaHCO3��ĩ�������ݲ�����˵����ˮ�к���H+ | |
| B�� | ��Ԫ�صķǽ�����ǿ���ף�����������Ҳǿ���� | |
| C�� | ũ������������ˮ������������Al ��OH�� 3����������� | |
| D�� | NH4F��Һ���ܴ���ڲ����Լ�ƿ�� |