题目内容
19.合成氨工业中,每生产2molNH3,放出92.4kJ热量.(1)写出合成氨反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1.
(2)已知:

1mol N-H键断裂吸收的能量等于391kJ.
(3)已知关于铁的氧化物存在下列三个热化学方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73kJ/mol ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ/mol ③
则CO还原FeO的热化学方程式为CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-218kJ/mol.
分析 (1)每生产2molNH3,放出92.4kJ热量,所以热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1;
(2)合成氨工业中:3H2+N2?2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391kJ;
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①;
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73kJ/mol ②;
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ/mol ③;
根据盖斯定律将方程式变形$\frac{1}{2}$×①-$\frac{1}{2}$×②-$\frac{1}{3}$×③得FeO(s)+CO(g)═Fe(s)+CO2(g).
解答 解:(1)每生产2molNH3,放出92.4kJ热量,所以热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1;
(2)合成氨工业中:3H2+N2?2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391kJ,故答案为:391;
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①;
Fe2O3(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+$\frac{1}{3}$CO2(g)△H=-15.73kJ/mol ②;
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ/mol ③;
根据盖斯定律将方程式变形$\frac{1}{2}$×①-$\frac{1}{2}$×②-$\frac{1}{3}$×③得:
FeO(s)+CO(g)═Fe(s)+CO2(g),△H=[$\frac{1}{2}$×(-24.8)-$\frac{1}{2}$×(-15.73kJ)-$\frac{1}{3}$×640.4kJ=-218kJ/mol,故答案为:-218.
点评 本题考查了化学能与热能关系分析判断,焓变计算应用,热化学方程式书写等知识,题目难度中等.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. | 13.8g | B. | 8.5g | C. | 9.8g | D. | 8.89 |
| A. | C4H10 | B. | C6H6 | C. | C6H14 | D. | C8H10 |
化合物18.0g$→_{高温煅烧}^{足量空气}$固体1$\stackrel{过量盐酸}{→}$溶液甲$\stackrel{足量Cl_{2}}{→}$溶液乙$→_{灼烧}^{加热、蒸发}$固体24.0g
下列说法不正确的是( )
| A. | 固体2是氧化铁 | |
| B. | X的化学式可以表示为Fe3C2 | |
| C. | 溶液甲中可能含有Fe3+ | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
| A. | $\frac{2b-c}{a}$ | B. | $\frac{2b-c}{2a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6}$ |
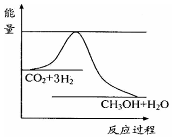 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol) -1该反应能否自发进行与温度 有关.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
②该反应为吸热(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2.
| A. | pH=6的降雨是酸雨 | |
| B. | 氯气泄漏后应顺风向低处跑 | |
| C. | SO2和HClO都具有漂白性,两者的漂白原理相同 | |
| D. | 我国城市环境中的大气污染物主要有SO2、NO2、可吸入颗粒物等 |
| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | X和Y形成的原子个数比为1:1的分子中极性键和非极性键之比为2:1 | |
| C. | Z元素在自然界中存在游离态 | |
| D. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) |
| A. | 葡萄糖溶液能产生丁达尔效应 | B. | 福尔马林可用于食品的防腐保鲜 | ||
| C. | 医用酒精可用于饮用水消毒 | D. | 淀粉、油脂、蛋白质可提供营养 |