题目内容
10.相同质量的下列有机物在氧气中充分燃烧,生成CO2最多的是( )| A. | C4H10 | B. | C6H6 | C. | C6H14 | D. | C8H10 |
分析 由C~O2~CO2,4H~O2~2H2O可知,消耗1molO2需要12gC,而消耗1molO2需要4gH,可知等质量时,烃中氢元素质量分数越大,消耗的O2越多,据此进行解答.
解答 解:由C~O2~CO2,4H~O2~2H2O可知,消耗1molO2需要12gC,而消耗1molO2需要4gH,可知等质量时,烃中氢元素质量分数越大,消耗的O2越多,
C4H10、C6H6、C6H14、C8H10中C、H原子数目之比分别为1:2.5、1:1、1:$\frac{7}{3}$、1:1.25,
所以C4H10、C6H6、C6H14、C8H10中C4H10的含氢量最大,则等质量燃烧时C4H10消耗的氧气最多,
故选A.
点评 本题考查有机物耗氧量的判断,题目难度不大,注意比较C、H原子消耗氧气的关系得出:等质量时烃中氢元素质量分数越大,消耗的O2越多,注意将乙醇改写为C2H4.H2O与乙烯比较,避免计算的繁琐,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.10mL某种气态烃,在50mL氧气中完全燃烧,得到液态水和体积为35mL的混合气体(所有气体体积都是在同温同压下测定),则下列烃中符合题意的烃是( )
| A. | CH4 | B. | C2H2 | C. | C3H8 | D. | C2H6 |
1.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A. | Fe3+、H+、SO42-、ClO- | B. | Fe3+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、SO42-、CO32- | D. | K+、H+、Br-、MnO4- |
18.下列实验操作中,正确的是( )
| A. | 配制0.1 mol•L-1 NaCl溶液时,其中一步是将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1 mol•L-1 NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1 mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1 mol•L-1 Na2CO3溶液500 mL,将Na2CO3放在托盘天平右盘称量 |
5.下列说法正确的是( )
| A. | 1mol任何物质都约含有6.02×1023个原子 | |
| B. | 物质的量为2mol的BaCl2中,含有Cl-个数为2NA | |
| C. | O2的摩尔质量是32 | |
| D. | 摩尔是物质的量的单位 |
2.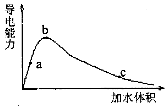 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的PH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的PH试纸上,测得PH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c |
20.下列溶液一定呈中性的是( )
| A. | PH=7的溶液 | |
| B. | 非电解质溶于水得到的溶液 | |
| C. | 由强酸和强碱等物质的量反应得到的物质 | |
| D. | c (H+)=c (OH-) |

