题目内容
16.苹果酯的结构简式如图所示,下列说法不正确的是( )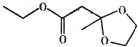
| A. | 苹果酯分子中含有14个氢原子 | |
| B. | 苹果酯能在NaOH溶液中发生水解反应 | |
| C. | 苹果酯能与金属钠反应产生氢气 | |
| D. | 苹果酯与C2H5OOCCH2CH2COOC2H5互为同分异构体 |
分析 苹果酯含有酯基,可发生水解反应,结合有机物结构简式确定分子式,以判断H原子数以及同分异构体,以此解答该题.
解答 解:A.由结构简式可知有机物分子式为C8H14O4,则含有14个氢原子,故A正确;
B.含有酯基,可在碱性条件下水解,故B正确;
C.只有酯基和醚基,与钠不反应,故C错误;
D.苹果酯与C2H5OOCCH2CH2COOC2H5的分子式都为,但结构不同C8H14O4,互为同分异构体,故D正确.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意有机物官能团种类和性质的判断,为解答该题的关键,易错点为有机物空分子式的确定,题目难度中等.

练习册系列答案
相关题目
6.直接排放含SO2,的烟气会形成胶雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①上表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab
a.c(Na+)═2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H +)═c(OH-)
c.c(Na+)+c(H +)═c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab
a.c(Na+)═2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H +)═c(OH-)
c.c(Na+)+c(H +)═c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
7.已知某溶液中含有碳酸钠、硫酸钠、氢氧化钠、氯化钠四种溶质,欲将该溶液中四种溶质的阴离子逐一检验出来,所加试剂先后顺序合理的是( )
| A. | HNO3、Ba(NO3)2、NH4NO3、AgNO3 | B. | HNO3、NH4NO3、Ba(NO3)2、AgNO3 | ||
| C. | NH4NO3、HNO3、Ba(NO3)2、AgNO3 | D. | NH4NO3、HNO3、AgNO3、Ba(NO3)2 |
4.化学与生活、社会发展息息相关,下列有关说法正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合、氧化还原反应 | |
| C. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| D. | 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀 |
1.常温时,有4种由水电离出的c(H+)均为1×10-13mol/L的溶液:①HCl溶液;②CH3COOH溶液;③NaOH溶液;④氨水.有关上述溶液的比较中,正确的是( )
| A. | 向等体积的①、②溶液中分别加水稀释100倍后,溶液的pH:①<② | |
| B. | 将等体积的①、③溶液分别与足量铝粉反应,生成H2的物质的量相等 | |
| C. | ②、③溶液等体积混合后,溶液显碱性 | |
| D. | ①、④溶液混合若pH=7,则消耗溶液的体积:①>④ |
8.下列实验设计、操作或实验现象不合理的是( )
| A. | 取某试样溶液少量,加入KSCN溶液无明显现象,再滴入几滴氯水,若溶液显血红色,说明原试样中含Fe2+ | |
| B. | 淀粉溶液和稀硫酸共热后,加碱中和,再加少量银氨溶液水浴加热,有光亮的银镜生成 | |
| C. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸,再做银镜反应或与新制Cu(OH)2共热的实验 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共沸几分钟,然后加入足量稀硝酸,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
5.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成
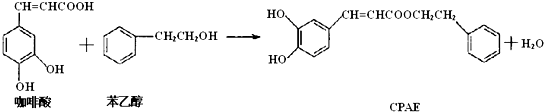
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 咖啡酸分子中所有原子不可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 1mol 苯乙醇在O2中完全燃烧,需消耗10molO2 | |
| D. | 1mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH |
6.下列有关热化学方程式正确的是( )
| 已知条件 | 热化学方程式 | |
| A | CH4的燃烧热(△H)为-890kJ• mol-1 | CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890kJ• mol-1 |
| B | 中和热△H=-57.3kJ•mol-1 | CH3COOH(aq)+NaOH(aq)═H2O+CH3COONa (aq)△H=-57.3kJ•mol-1 |
| C | 一定条件下,0.5mol N2与1.5mol H2充分反应后放出30.5kJ的热量 | N2(g)+3H2(g)?2NH3(g)△H=-61kJ•mol-1 |
| D | 96g O2的能量比96g O3的能量低bkJ | 3O2(g)?2O3(g)△H=+bkJ• mol-1 |
| A. | A | B. | B | C. | C | D. | D |
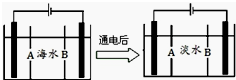 科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.
科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.