题目内容
7.已知某溶液中含有碳酸钠、硫酸钠、氢氧化钠、氯化钠四种溶质,欲将该溶液中四种溶质的阴离子逐一检验出来,所加试剂先后顺序合理的是( )| A. | HNO3、Ba(NO3)2、NH4NO3、AgNO3 | B. | HNO3、NH4NO3、Ba(NO3)2、AgNO3 | ||
| C. | NH4NO3、HNO3、Ba(NO3)2、AgNO3 | D. | NH4NO3、HNO3、AgNO3、Ba(NO3)2 |
分析 检验氢氧化钠,可加入铵盐,生成刺激性气味的气体,然后加入硝酸检验碳酸钠,加入硝酸钡检验硫酸钠,过滤后加入硝酸银检验氯化钠,注意加入试剂不能干扰其它离子的,以此解答该题.
解答 解:先加硝酸,氢离子与碳酸根离子生成气体,可以鉴别出碳酸钠,但硝酸也可和氢氧化钠反应生成水,没有明显现象,又除去了氢氧根离子,故A、B错误;
铵根离子与氢氧根离子反应生成具有刺激性气味的气体,加入硝酸铵可以证明氢氧化钠的存在;再加入稀硝酸,有气体生成,证明含有碳酸钠;加入硝酸钡,钡离子与硫酸根离子生成硫酸钡沉淀,可以证明含有硝酸钡;最后加入硝酸银,银离子与氯离子反应生成氯化银白色沉淀,证明含有氯化钠,可以将四种溶质都证明出来,如先加入硝酸银,则硫酸银、氯化银都生成沉淀,不能鉴别,故C正确、D错误.
故选C.
点评 本题考查物质的检验和鉴别,为高考常见题型,侧重学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握物质的性质的异同以及实验的严密性,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.某未知溶液(只含一种溶质)中加入醋酸钠固体后,测得溶液中c(CH3COO-):c(Na+)=1:1.则原未知溶液一定不是( )
| A. | 强酸溶液 | B. | 弱酸性溶液 | C. | 弱碱性溶液 | D. | 强碱溶液 |
2.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.说法正确的是( )
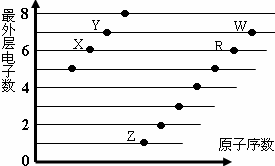

| A. | 元素非金属性:X>R>W | |
| B. | X与R形成的分子内含两种作用力 | |
| C. | X、Z形成的化合物中可能含有共价键 | |
| D. | 元素对应的离子半径:W>R>X |
12.现有五种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素.下列说法不正确的是( )
| A. | 原子半径:Y<Q<W | |
| B. | ZX3可使紫色石蕊溶液变蓝 | |
| C. | X、Z、Q三种元素可组成离子化合物或共价化合物 | |
| D. | X2Q2、Y2X6两种分子中含有的电子数相同 |
19.关于热化学方程式:H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1的叙述正确的是( )
| A. | 一分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1mol H2和Cl2完全反应生成2mol HCl放出的热量为184.6kJ | |
| C. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,放出的热量为184.6 kJ | |
| D. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,吸收的热量为184.6kJ |
16.苹果酯的结构简式如图所示,下列说法不正确的是( )
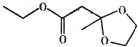

| A. | 苹果酯分子中含有14个氢原子 | |
| B. | 苹果酯能在NaOH溶液中发生水解反应 | |
| C. | 苹果酯能与金属钠反应产生氢气 | |
| D. | 苹果酯与C2H5OOCCH2CH2COOC2H5互为同分异构体 |
 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.