题目内容
4.足量CaCO3跟40mL 5mol/L的盐酸充分反应后.求:(1)生成的CO2在标准状况下的体积.
(2)消耗CaCO3的质量.
分析 利用40mL 5mol/L的盐酸的物质的量,根据反应的化学方程式,计算参加反应的碳酸钙的质量,生成二氧化碳的物质的量,然后根据V=nVm,进行计算解答.
解答 解:40mL 5mol/L的盐酸的物质的量为:40×5×10-3mol=0.2mol,设生成的CO2在标准状况下的体积为VL,消耗CaCO3的质量为xg,
由反应方程式CaCO3+2HCl═CaCl2+H2O+CO2↑
100g 2mol 22.4L
xg 0.2mol VL
所以$\frac{100g}{xg}=\frac{2mol}{0.2mol}=\frac{22.4L}{VL}$
解之得:x=10g,V=2.24L,
答:(1)生成的CO2在标准状况下的体积为2.24L.
(2)消耗CaCO3的质量为10g.
点评 本题主要考查了质量守恒定律的应用和根据化学方程式进行有关的计算,要注意解题的步骤和计算结果的准确性,此题难度不大.

练习册系列答案
相关题目
1.糖类、油脂、蛋白质是人体必须的三大营养物质.下列说法正确的是( )
| A. | 蔗糖和麦芽糖均能发生水解反应和银镜反应 | |
| B. | 植物油可用于萃取碘水中的碘 | |
| C. | 面粉、牛油、丝绸完全燃烧都只生成CO2和H2O | |
| D. | 用渗析的方法不能对鸡蛋白和淀粉的混合溶液进行分离 |
15.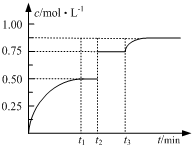 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:
A(g)+B(g)?2C(g)+D(s)t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:A(g)+B(g)?2C(g)+D(s)t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
| A. | 若t1=2,则反应在0~2 min内的平均速率为v(A)=0.50 mol•(L•min)-1 | |
| B. | 若t3时刻升高了温度,则该反应的△H>0 | |
| C. | 若t1时刻后向体系中加入A、B、C各1 mol,则υ(正)>υ(逆) | |
| D. | 温度不变,若起始向容器中加入1 mol A、1 mol B、2 mol D,则达平衡时A的转化率小于50% |
12.在空气中能稳定存在的物质是( )
| A. | 石灰水 | B. | 氯水 | C. | 次氯酸钠 | D. | 食盐水 |
19.在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质固体的是( )
| A. | 硝酸铝 | B. | 碳酸氢钠 | C. | 硫酸镁 | D. | 亚硫酸钠 |
16.药物是人类抵御疾病的重要武器之一.下列有关药物的说法不正确的是( )
| A. | “胃得乐”(主要成分为碳酸镁)是一种抗酸药) | |
| B. | 鸦片、吗啡、海洛因等这些物质属于毒品 | |
| C. | 青霉素能抑制细菌细胞壁的生长,致使细菌因细胞破裂而死亡 | |
| D. | “阿司匹林”是一种重要的抗生素 |
13.最近中国科学院上海高等研究院在合成气直接制烯烃研究获重大突破.已知:
反应①:C(s)+$\frac{1}{2}$O2(g)=CO (g)△H1
反应②:C(s)+H2O(g)=CO(g)+H2(g)△H2
反应③:CO(g)+2H2(g)=CH3OH(g)△H 3=-90.1kJ•mol-1
反应④:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H 4=-134.0kJ•mol-1
反应⑤:3CH3OH(g)=CH3CH=CH2(g)+3H2O(g)△H 5=-31.0kJ•mol-1
下列说法正确的是( )
反应①:C(s)+$\frac{1}{2}$O2(g)=CO (g)△H1
反应②:C(s)+H2O(g)=CO(g)+H2(g)△H2
反应③:CO(g)+2H2(g)=CH3OH(g)△H 3=-90.1kJ•mol-1
反应④:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H 4=-134.0kJ•mol-1
反应⑤:3CH3OH(g)=CH3CH=CH2(g)+3H2O(g)△H 5=-31.0kJ•mol-1
下列说法正确的是( )
| A. | △H1-△H2<0 | |
| B. | 反应②为放热反应 | |
| C. | 3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g)△H=-103.0 kJ•mol-1 | |
| D. | 3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g)△H=-301.3kJ•mol-1 |
14.将200mL0.1mol•L-1的H2SO4溶液与200mL0.2mol•L-1的H2SO4溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中SO42-浓度是( )
| A. | 0.2mol•L-1 | B. | 0.15mol•L-1 | C. | 0.04mol•L-1 | D. | 0.4mol•L-1 |