题目内容
17.下列物质中不能导电,又不是电解质和非电解质的是( )| A. | 食盐溶 | B. | 石墨晶体 | C. | 液氯 | D. | 铜 |
分析 含有自由移动的电子或者离子就能导电,在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,单质既不是电解质也不是非电解质,据此分析.
解答 解:A.食盐溶液能电离出自由移动的阴阳离子,能导电,但属于混合物,不是电解质也不是非电解质,故A错误;
B.石墨晶体是单质,既不是电解质也不是非电解质,但含有自由移动的电子能导电,故B错误;
C.液氯是单质,既不是电解质也不是非电解质,也不含有自由移动的电子或者离子,不能导电,故C正确;
D.铜是单质,既不是电解质也不是非电解质,但含有自由移动的电子能导电,故D错误.
故选C.
点评 本题考查电解质、非电解质的概念以及是否导电的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.

练习册系列答案
相关题目
14.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力相当 | |
| D. | 25℃时,将等体积pH=1的盐酸和和水混合,混合后溶液的pH=1.3 |
8.雾霾天气中SO2是造成空气污染的主要原因;在硫酸工业生产过程中2SO2(g)+O2(g)?2SO3(g)是关键步骤.该反应的过程在600℃时的平衡常数K=19,有关的能量变化,实验数据如图所示.
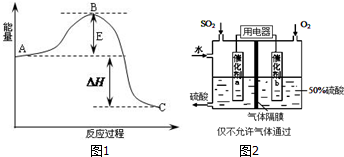
(1)已知1mol SO2(g)氧化为1mol SO3(g)时的△H=-99kJ/mol.则图中△H=198 kJ/mol; E代表的意义是正反应活化能.结合表中的数据解释该反应是放热反应的原因:压强一定时,温度升高,SO2转化率下降,说明升温有利于逆反应进行,所以正反应为放热反应;若600℃时,在一密闭容器中,将二氧化硫和氧气混合,当测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,化学反应速率是v(正)> v(逆)(填“>”、“<”或“=”).
(2)硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3.已知在0.1mol/L的NaHSO3溶液中有关微粒浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3).该溶液中c(H+)>c(OH-)(填“>”、“<”或“=”),简述理由(用简单的文字和离子方程式说明):NaHSO3溶液中存在反应:HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3,由于c(SO32-)>c(H2SO3),所以电离程度大于水解.
(3)有人设想用电化学原理生产硫酸(装置见图2),写出通入SO2的电极的电极反应式:SO2+2H2O-2e-=SO42-+4H+;为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为16:29.

| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(2)硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3.已知在0.1mol/L的NaHSO3溶液中有关微粒浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3).该溶液中c(H+)>c(OH-)(填“>”、“<”或“=”),简述理由(用简单的文字和离子方程式说明):NaHSO3溶液中存在反应:HSO3-?H++SO32-、HSO3-+H2O?OH-+H2SO3,由于c(SO32-)>c(H2SO3),所以电离程度大于水解.
(3)有人设想用电化学原理生产硫酸(装置见图2),写出通入SO2的电极的电极反应式:SO2+2H2O-2e-=SO42-+4H+;为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为16:29.
12.在空气中能稳定存在的物质是( )
| A. | 石灰水 | B. | 氯水 | C. | 次氯酸钠 | D. | 食盐水 |
2.下列实验操作所用仪器合理的是( )
| A. | 把烧杯内的溶液转移到容量瓶中时,必须用玻璃棒引流 | |
| B. | 用100mL量筒量取95.20 mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用500mL容量瓶配制50mL0.10mol/L溶液 |
6.2015年末,在巴黎召开的全球气候变化大会讨论了“全球气温升高过快”的议题.该议题的实质是如何减少排放下列气体中的( )
| A. | H2 | B. | CO2 | C. | N2 | D. | O2 |