题目内容
1.下列有关物质性质的应用正确的是( )| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | 氯化钠是电解质,可电解其水溶液获得金属钠 | |
| C. | SO2有还原性,常用来漂白纸浆 | |
| D. | 四氯化碳密度比水大,可用于萃取溴水中的溴 |
分析 A.液氨的沸点高,易液化,汽化时吸收大量的热;
B.电解NaCl溶液生成NaOH、氢气、氯气;
C.二氧化硫具有漂白性,可漂白纸浆;
D.四氯化碳不溶于水,溴不易溶于水,易溶于四氯化碳.
解答 解:A.液氨的沸点高,易液化,汽化时吸收大量的热,则液氨可用作制冷剂,故A正确;
B.电解NaCl溶液生成NaOH、氢气、氯气,应利用电解熔融NaCl获得Na,故B错误;
C.二氧化硫具有漂白性,可漂白纸浆,与还原性无关,故C错误;
D.四氯化碳不溶于水,溴不易溶于水,易溶于四氯化碳,则四氯化碳可萃取溴水中的溴,与密度无关,故D错误;
故选A.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析和应用能力的考查,注意性质与用途的关系,题目难度不大.

练习册系列答案
相关题目
12.实验室模拟合成 和CH3CH2CH2Br的方法如图1.
和CH3CH2CH2Br的方法如图1.
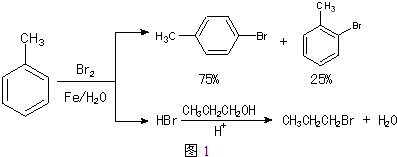
已知:甲苯和液溴在有少量水存在时也能反应(如图2):
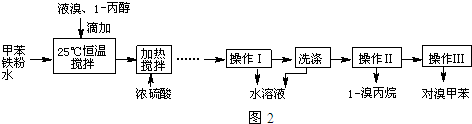
实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如表:
(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入水(或H2O或蒸馏水),以减少溴的挥发.写出甲苯和液溴反应生成对溴甲苯的化学方程式 .
.
(2)反应装置如图3所示:
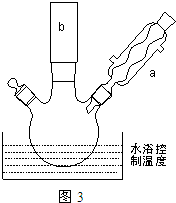 ①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.
①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.
②三颈烧瓶中开始加入了甲苯、铁粉和水.加入的适量水的作用是:易于控制温度和吸收反应生成的HBr气体.加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是催化剂.
(3)操作I的名称是分液,操作Ⅲ的名称是蒸馏.
(4)操作I分离出的水溶液中含有HBr、H2SO4和Fe3+,某同学为测定溶液的pH,设计方案如下:将所得水溶液稀释至l000mL,取出20.00mL,用0.1000mol•L-1 NaOH溶液滴定,以测定溶液pH.该同学认为无需加入指示剂,也能完成滴定.他提出这一观点的理由是滴定终点时,有红褐色Fe(OH)3沉淀生成,可以指示滴定终点.
 和CH3CH2CH2Br的方法如图1.
和CH3CH2CH2Br的方法如图1.
已知:甲苯和液溴在有少量水存在时也能反应(如图2):

实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如表:
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
| 沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
 .
.(2)反应装置如图3所示:
 ①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.
①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.②三颈烧瓶中开始加入了甲苯、铁粉和水.加入的适量水的作用是:易于控制温度和吸收反应生成的HBr气体.加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是催化剂.
(3)操作I的名称是分液,操作Ⅲ的名称是蒸馏.
(4)操作I分离出的水溶液中含有HBr、H2SO4和Fe3+,某同学为测定溶液的pH,设计方案如下:将所得水溶液稀释至l000mL,取出20.00mL,用0.1000mol•L-1 NaOH溶液滴定,以测定溶液pH.该同学认为无需加入指示剂,也能完成滴定.他提出这一观点的理由是滴定终点时,有红褐色Fe(OH)3沉淀生成,可以指示滴定终点.
16.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
| A. | W与X形成的化合物溶于水后溶液呈碱性 | |
| B. | 简单离子半径:W<X<Z | |
| C. | 气态氢化物的热稳定性:W<Y | |
| D. | 最高价氧化物的水化物的酸性:Y>Z |
6.${\;}_{92}^{235}$U是重要的核工业原料,下列关于${\;}_{92}^{235}$U说法正确的是( )
| A. | ${\;}_{92}^{235}$U原子核中含有92个中子 | B. | ${\;}_{92}^{235}$U原子核外有143个电子 | ||
| C. | ${\;}_{92}^{235}$U的质量数为92 | D. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U互为同位素 |
13.已知短周期元素的离子:aAm+、bBn+、cCm-、dDn-(m>n)都具有相同的电子层结构,则下列叙述正确的是( )
①原子半径:A>B>C>D
②离子半径:C>D>B>A
③原子序数:d>c>b>a
④最外层电子数:D>C>B>A
⑤金属性:B>A>D>C
⑥a-b=m+n
⑦b-c=m+n.
①原子半径:A>B>C>D
②离子半径:C>D>B>A
③原子序数:d>c>b>a
④最外层电子数:D>C>B>A
⑤金属性:B>A>D>C
⑥a-b=m+n
⑦b-c=m+n.
| A. | ②④⑦ | B. | ②⑤⑥ | C. | ①⑤⑦ | D. | ②⑦ |
10.在元素R的原子中,最外层上的电子数比次外层上的电子数多2个,则R不能形成的化台物是( )
| A. | RO | B. | R2H4 | C. | HRO2 | D. | H2R2O4 |
 有A、B、C、D四种有机物,A、B、C都属于烃类物质,D是烃的衍生物.A是含氢量最大的有机物,分子结构为正四面体;B的球棍模型为
有A、B、C、D四种有机物,A、B、C都属于烃类物质,D是烃的衍生物.A是含氢量最大的有机物,分子结构为正四面体;B的球棍模型为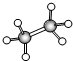 ;C的比例模型为
;C的比例模型为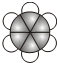 ;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应.
;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.