题目内容
18.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如表:| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与热水反应,再向反应后溶液中滴加酚酞 | A.浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| 2.向Na2S溶液中滴加新制的氯水 | B.产生气体,可在空气中燃烧,溶液变成浅红色 |
| 3.钠与滴有酚酞试液的冷水反应 | C.反应不十分强烈,产生的气体可以在空气中燃烧 |
| 4.镁带与2mo1•L-1的盐酸反应 | D.剧烈反应,产生可燃性气体 |
| 5.铝条与2mo1•L-1的盐酸反应 | E.生成白色胶状沉淀,既而沉淀消失 |
| 6.向A1Cl3溶液滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:验证第三周期元素从左到右金属性递减、非金属性递增的规律.
(2)实验仪器:试管、酒精灯、镊子、小刀、玻璃片、胶头滴管等.
(3)实验内容:(填写题给信息表中的序号和字母):
| 实验方案 | 实验现象 | 有关化学方程式 |
(5)请用物质结构理论简单说明具有上述结论的原因:Na、Mg、Al、S、Cl原子半径随电子数增多而减小,所以核对最外层电子的吸引力依次增强,失电子能力减弱,得电子能力增强.
(6)请你补充两组简单易行的实验方案,证明此周期另外两种主族元素性质的递变规律.
(7)本周期单核离子半径最小的粒子的符号是Al 3+.
分析 (1)实验目的为同周期元素性质递变规律;
(2)根据实验步骤来选择所需的实验仪器;
(3)金属的金属性越强,其单质与酸或水反应越剧烈,氢氧化铝能溶于强碱NaOH溶液生成可溶性的偏铝酸钠,硫化钠能被氯气氧化;
(4)元素的金属性越强,金属与水或与酸反应的剧烈程度,其最高价氧化物的水化物的碱性越强;非金属的非金属性越强,其单质的氧化性越强;
(5)同周期由左向右原子半径逐渐减小,核电核数逐渐增大,则原子核对核外电子的吸引能力逐渐增强即失电子能力减弱,得电子能力增强;
(6)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
(7)本周期单核离子半径最小的粒子是铝离子.
解答 解:(1)根据题意“某同学做同周期元素性质递变规律实验时”以及所做实验可以判断,本实验的实验目的是:验证第三周期元素从左到右金属性递减、非金属性递增的规律.
故答案为:验证第三周期元素从左到右金属性递减、非金属性递增的规律;
(2)根据每个实验过程可知,这些实验要用到的仪器有:试管、酒精灯、镊子、小刀、玻璃片、胶头滴管等;
故答案为:试管、酒精灯、镊子、小刀、玻璃片、胶头滴管等;
(3)根据元素周期表第三周期元素的排列顺序,可确定实验操作顺序和相关的实验现象等(如下表).
| 实验方案 | 实验现象 | 有关化学方程式 |
| 3 | A | 2Na+2H2O═2NaOH+H2↑ |
| 1 | B | Mg+2H2O═Mg(OH)2+H2↑ |
| 4 | D | Mg+2HCl═MgCl2+H2↑ |
| 5 | C | 2Al+6HCl═2AlCl3+3H2↑ |
| 6 | E | AlCl3+3NaOH═Al(OH)3↓+3NaCl Al(OH)3+NaOH═NaAlO2+2H2O |
| 2 | F | H2S+Cl2═2HCl+S↓ |
故答案为;金属性:Na>Mg>Al,非金属性:Cl>S;
(5)Na、Mg、Al、S、Cl,原子核外都有三个电子层,但原子半径随电子数增多而减小,所以核对最外层电子的吸引力依次增强,失电子能力减弱,得电子能力增强;
故答案为:Na、Mg、Al、S、Cl原子半径随电子数增多而减小,所以核对最外层电子的吸引力依次增强,失电子能力减弱,得电子能力增强;
(6)可向硅酸钠溶液中滴加磷酸,有白色胶状沉淀产生,表明磷酸酸性比硅酸酸性强,则磷的非金属性比硅强.
故答案为:可向硅酸钠溶液中滴加磷酸,观察是否有白色胶状沉淀产生;
(7)第三周期元素,其原子先失电子后得电子,电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以第三周期元素中离子半径最小的是Al 3+,
故答案为:Al 3+.
点评 本题考查性质实验方案设计,为高频考点,侧重考查学生实验操作、实验观察及实验设计能力,明确实验原理、物质性质及其递变规律是解本题关键,熟练掌握第三周期元素周期律并灵活运用,题目难度不大.

练习册系列答案
相关题目
6.下列关于同系物的说法错误的是
① 和
和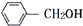 互为同系物,均可以与金属钠反应.
互为同系物,均可以与金属钠反应.
②苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色.
③同系物在水中的溶解性相同,苯的同系物都难溶于水,乙醇的同系物都易溶于水.
④烷烃的密度随分子量增大而增大,液态烷烃的密度小于水的密度,固态烷烃的密度大于水的密度.
⑤同系物的分子式可以用一个通式概括,符合通式CnH2nO的物质是饱和一元醛.
⑥乙二醇和丙三醇互为同系物.( )
①
 和
和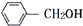 互为同系物,均可以与金属钠反应.
互为同系物,均可以与金属钠反应.②苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色.
③同系物在水中的溶解性相同,苯的同系物都难溶于水,乙醇的同系物都易溶于水.
④烷烃的密度随分子量增大而增大,液态烷烃的密度小于水的密度,固态烷烃的密度大于水的密度.
⑤同系物的分子式可以用一个通式概括,符合通式CnH2nO的物质是饱和一元醛.
⑥乙二醇和丙三醇互为同系物.( )
| A. | .③④⑤⑥ | B. | ①②③④ | C. | ①②⑤⑥ | D. | ①②③④⑤⑥ |
13.下列说法中正确的是( )
| A. | 石油裂解可以得到氯乙烯 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 所有烷烃和蛋白质中都存在碳碳单键 | |
| D. | 蔗糖和麦芽糖的组成都是C12H22O11,水解产物均含有葡萄糖 |
3.如图是维生素A的结构简式,关于它的说法中不正确的是( )


| A. | 1个分子中有5个碳碳双键 | |
| B. | 能使高锰酸钾溶液褪色 | |
| C. | 能与碳酸钠溶液反应放出CO2气体 | |
| D. | 能发生加成反应、氧化反应、置换反应 |
10.下列物质中,可用于制选光导纤维的材料是( )
| A. | 陶瓷 | B. | 铜合金 | C. | 聚乙烯 | D. | 二氧化硅 |
7.关于A(g)+2B(g)═3C(g)的化学反应,下列该反应速率最大的是( )
| A. | v(A)=0.6 mol/(L•min) | B. | v(B)=1.2 mol/(L•min) | ||
| C. | v(C)=1.2 mol/(L•min) | D. | v(B)=0.03 mol/(L•s) |
8.高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为:2MnO4-+16H++10Cl-=2 Mn2++5Cl2↑+8H2O.
(2)装置B的作用是除杂和安全瓶,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象锥形瓶中液面下降,长颈漏斗中液面上升.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入c.(选a或b或c)
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴.打开活塞,将D中的少量溶液加入E中,振荡E.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.该现象不能(填“能”或“不能”)说明溴的非金属性强于碘,原因是过量的Cl2也可将I-氧化为I2.
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为:2MnO4-+16H++10Cl-=2 Mn2++5Cl2↑+8H2O.
(2)装置B的作用是除杂和安全瓶,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象锥形瓶中液面下降,长颈漏斗中液面上升.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入c.(选a或b或c)
| a | b | c | |
| I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |