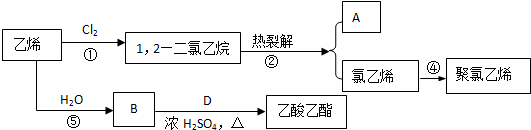
题目内容
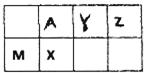 五种短周期元素在周期表中的位置如图,其中M、X、Z在地壳中的含量居前三位.
五种短周期元素在周期表中的位置如图,其中M、X、Z在地壳中的含量居前三位.(1)指出Y元素在周期表中的位置:
(2)M、X的单质,以及M、X分别与Z形成的化合物都能与NaOH溶液反应.
写出M单质以及X、Z形成的化合物分别与NaOH溶液反应的化学方程式:
(3)A的最高价氧化物对应水化物的酸性
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:M、X、Z在地壳中的含量居前三位,地壳中含量前三位的元素分别为:O、Si、Al,依据M、X、Z在周期表中的位置可推断:M为Al,X为Si,Z为氧,同时可推断得出Y为氮,A为碳,据此解答各小题即可.
解答:
解:依据分析可知A为碳,Y为氮,Z为氧,M为铝,X为硅,
(1)Y为N,N元素2个电子层,最外层5个电子,处于第二周期第ⅤA族,N与O在放电或高温条件下反应生成NO,化学反应方程式为:N2+O2
2NO,故答案为:第二周期第ⅤA族;N2+O2
2NO;
(2)M为铝,Al与氢氧化钠、水反应生成偏铝酸钠、氢气,化学反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,XZ形成的化合物为二氧化硅:SiO2,SiO2为酸性氧化物,与氢氧化钠反应生成硅酸钠和水,化学反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;SiO2+2NaOH=Na2SiO3+H2O;
(3)C的最高价氧化物的水化物为碳酸:H2CO3,Si的最高价氧化物的水化物为硅酸:H2SiO3,碳酸酸性强于硅酸,利用碳酸可以制取硅酸,化学反应方程式为:H2O+CO2+Na2SiO3=H2SiO3↓+Na2CO3,故答案为:强于;H2O+CO2+Na2SiO3=H2SiO3↓+Na2CO3.
(1)Y为N,N元素2个电子层,最外层5个电子,处于第二周期第ⅤA族,N与O在放电或高温条件下反应生成NO,化学反应方程式为:N2+O2
| ||
| ||
(2)M为铝,Al与氢氧化钠、水反应生成偏铝酸钠、氢气,化学反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,XZ形成的化合物为二氧化硅:SiO2,SiO2为酸性氧化物,与氢氧化钠反应生成硅酸钠和水,化学反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;SiO2+2NaOH=Na2SiO3+H2O;
(3)C的最高价氧化物的水化物为碳酸:H2CO3,Si的最高价氧化物的水化物为硅酸:H2SiO3,碳酸酸性强于硅酸,利用碳酸可以制取硅酸,化学反应方程式为:H2O+CO2+Na2SiO3=H2SiO3↓+Na2CO3,故答案为:强于;H2O+CO2+Na2SiO3=H2SiO3↓+Na2CO3.
点评:本题主要考查的是元素的推断以及元素化合物的知识,注意化学反应方程式的正确书写是关键.

练习册系列答案
相关题目
某溶液中大量存在如下五种离子:NO3-、SO42-、Fe3+、H+、M,它们的物质的量之比依次为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能是( )
| A、Al3+ |
| B、Mg2+ |
| C、CO32- |
| D、Ba2+ |
下列物质中,属于电解质的是( )
| A、乙醇 | B、NaCl |
| C、Mg | D、NaOH溶液 |
用NA表示阿伏加德罗常数,下列说法不正确的是( )
| A、2mol SO2和1mol O2在一定条件下反应,反应后分子总数大于2NA |
| B、25℃时,在pH=2的1.0L H2SO4溶液中含有H+的数目是0.01NA |
| C、在二氧化硅的晶体中,1mol SiO2含有Si-O键数目为4NA |
| D、25ml 18mol?L-1浓硫酸与足量的Zn反应,转移电子数为0.225NA |
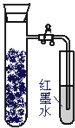 如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞.几分钟后,打开止水夹,观察到导管中水柱上升.对此过程所作的分析正确的是( )
如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞.几分钟后,打开止水夹,观察到导管中水柱上升.对此过程所作的分析正确的是( )| A、碳粉在电化学腐蚀过程中作负极 |
| B、炭粉被氧化 |
| C、发生了吸氧腐蚀 |
| D、发生了析氢腐蚀 |
下列除去杂质的方法正确的是( )
| A、除去BaSO4中少量BaCO3:加入足量盐酸,充分反应后,过滤、洗涤、干燥 |
| B、除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
| C、除去CO2气体中混有的CO气体:混合气通过灼热的铜网 |
| D、除去CO2气体中混有的HCl气体:通入氢氧化钠溶液洗气 |