题目内容
用NA表示阿伏加德罗常数,下列说法不正确的是( )
| A、2mol SO2和1mol O2在一定条件下反应,反应后分子总数大于2NA |
| B、25℃时,在pH=2的1.0L H2SO4溶液中含有H+的数目是0.01NA |
| C、在二氧化硅的晶体中,1mol SiO2含有Si-O键数目为4NA |
| D、25ml 18mol?L-1浓硫酸与足量的Zn反应,转移电子数为0.225NA |
考点:阿伏加德罗常数
专题:
分析:A、二氧化硫和氧气反应是可逆反应存在化学平衡;
B、pH=2的溶液中氢离子浓度为0.01mol/L,根据n=cV计算出该溶液中含有的氢离子的物质的量,再计算出含有氢离子数目;
C、SiO2中每个Si与4个O相连,而每个O与2个Si相连,根据均摊法计算出1mol二氧化硅中含有的硅氧键数目;
D、浓硫酸与锌反应生成二氧化硫和硫酸锌,稀硫酸与锌反应生成氢气和硫酸锌,由于无法计算生成二氧化硫和氢气的物质的量,则无法计算转移的电子数.
B、pH=2的溶液中氢离子浓度为0.01mol/L,根据n=cV计算出该溶液中含有的氢离子的物质的量,再计算出含有氢离子数目;
C、SiO2中每个Si与4个O相连,而每个O与2个Si相连,根据均摊法计算出1mol二氧化硅中含有的硅氧键数目;
D、浓硫酸与锌反应生成二氧化硫和硫酸锌,稀硫酸与锌反应生成氢气和硫酸锌,由于无法计算生成二氧化硫和氢气的物质的量,则无法计算转移的电子数.
解答:
解:A、二氧化硫和氧气反应是可逆反应存在化学平衡,混合气体物质的量大于2mol,故A正确;
B、25℃,在pH=2的1.0L H2SO4溶液中,氢离子浓度为0.01mol/L,氢离子的物质的量为0.01mol,则溶液中含有H+数目为0.01NA,故B正确;
C、SiO2中每个Si与4个O相连,而每个O与2个Si相连,1mol二氧化硅中含有1mol硅原子、2mol氧原子,根据均摊法,1mol硅形成的共价键的物质的量为:1mol×
×4=2mol,2mol氧原子形成的硅氧键为:2mol×
×2=2mol,所以1mol二氧化硅中含有4mol硅氧键,含有Si-O键数目为4NA,故C正确;
D、25mL 18mol?L-1浓硫酸中含有硫酸的物质的量为0.9mol,由于浓硫酸与锌反应生成硫酸锌和二氧化硫,稀硫酸与锌反应生成氢气,无法计算生成的二氧化硫和氢气的物质的量,则无法计算转移电子数,故D错误;
故选D.
B、25℃,在pH=2的1.0L H2SO4溶液中,氢离子浓度为0.01mol/L,氢离子的物质的量为0.01mol,则溶液中含有H+数目为0.01NA,故B正确;
C、SiO2中每个Si与4个O相连,而每个O与2个Si相连,1mol二氧化硅中含有1mol硅原子、2mol氧原子,根据均摊法,1mol硅形成的共价键的物质的量为:1mol×
| 1 |
| 2 |
| 1 |
| 2 |
D、25mL 18mol?L-1浓硫酸中含有硫酸的物质的量为0.9mol,由于浓硫酸与锌反应生成硫酸锌和二氧化硫,稀硫酸与锌反应生成氢气,无法计算生成的二氧化硫和氢气的物质的量,则无法计算转移电子数,故D错误;
故选D.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项C为易错点,注意均摊法的应用.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、非金属气态氧化物都不是电解质 |
| B、SO2、NO2、C02都会导致酸雨的形成 |
| C、氮的氧化物都属于大气污染物 |
| D、Si、S的氧化物均属于酸性氧化物 |
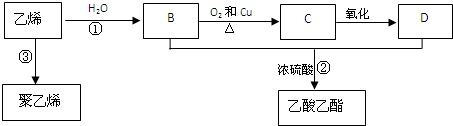
下列关于物质应用的说法错误的是( )
| A、玻璃容器可长期盛放各种酸 |
| B、纯碱可用于清洗油污 |
| C、浓氨水可检验氯气管道漏气 |
| D、通过浓硫酸除去NH3中的H2O |
下列混合物的蒸气在一定温度和压强下,只要总体积一定,完全燃烧消耗氧气的体积也一定的是( )
①乙醇和乙醚 ②丙醛和丙炔 ③甲烷和甲酸甲酯 ④C5H12和C6H8⑤丙酮和丙二醇.
①乙醇和乙醚 ②丙醛和丙炔 ③甲烷和甲酸甲酯 ④C5H12和C6H8⑤丙酮和丙二醇.
| A、②③④⑤ | B、①②③④⑤ |
| C、②③④ | D、③④⑤ |
关于电化学的有关说法不正确的是( )
| A、研究化学能与电能相互转换的装置、过程和效率的科学,叫做电化学 |
| B、化学能与热能、化学能与电能都可以通过化学反应直接转换 |
| C、电化学反应过程可以分为产生电流的反应和借助电流而发生的反应两类 |
| D、电化学的应用包括电解、电镀、电冶金、电池制造等方面 |
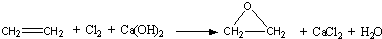
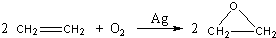
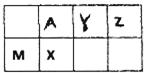 五种短周期元素在周期表中的位置如图,其中M、X、Z在地壳中的含量居前三位.
五种短周期元素在周期表中的位置如图,其中M、X、Z在地壳中的含量居前三位. 太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层.
太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层.