题目内容
6.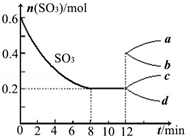 在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:(1)根据8min时到达平衡,算出该反应的平衡常数值为0.4.
(2)用O2表示0到8min内该反应的平均速率v=0.0125mol/(L•min).
(3)能说明该反应已达到平衡状态的是B、C.
A、v(SO3)=2v(O2) B、容器内压强保持不变
C、v(SO2)逆=2v(O2)正D、容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为C.
A、a B、b C、c D、d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向正反应方向移动(填“正”或“逆”).SO3的体积分数增大(填“增大”或“减小”).
分析 1、平衡常数K=$\frac{[SO2]2•[O2]}{[SO3]2}$.
2、平均速率v=$\frac{△c}{△t}$.
3、判断是否达到平衡状态的方法:正反应速率等于逆反应速率;对于有体积变化的反应,容器内压强保持不变.
4、能使平衡发生移动的因素:温度、压强、浓度,平衡移动的方向与减弱这种因素的方向相同.
解答 解:(1)通过读图可知,初始SO3的物质的量为0.6mol,平衡时SO3的物质的量为0.2mol,在2L的密闭容器中发生反应,则有
2SO3(g)?2SO2(g)+O2(g)
初始量(mol):0.6
转化量(mol):0.4 0.4 0.2
平衡量(mol):0.2 0.4 0.2
平衡时各物质的浓度分别为:[SO3]=0.1mol•L-1,[SO2]=0.2mol•L-1,[O2]=0.1mol•L-1
所以平衡常数K=$\frac{[SO2]2•[O2]}{[SO3]2}$=$\frac{0.2×0.2×0.1}{0.1×0.1}$=0.4
故答案为:0.4;
(2 )用O2表示0到8min内该反应的平均速率v=$\frac{△c(O2)}{△t}$=$\frac{0.1mol•L-1}{8min}$=0.0125mol/(L•min)
故答案为:0.0125mol/(L•min);
(3)A、表示同一方向反应速率,v(SO2)自始至终为v(O2)的2倍,不能说明达到平衡,故A错误;
B、该反应前后气体体积变化,所以压强不变,反应已达到平衡状态,故B正确;
C、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,v逆(SO2):v正(O2)=2:1,v逆(SO2)=2v正(O2),故C正确;
D、根据质量守恒,化学反应前后混合物的质量不变,容器体积不变,所以密度始终不变,故D错误;
故选:B、C;
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为,相当于增大压强,瞬间物质的量不变,但平衡逆向移动,所以三氧化硫的物质的量增加,
故选:C;
(5)若保持容积不变在第12min时,加入SO3(g),平衡正向移动;体积不变相当于增大压强,SO3的体积分数增大,
故答案为:正;增大.
点评 本题综合了平衡常数、反应速率、平衡状态的判断以及平衡的移动,非常的基础全面,是个经典的好题.

| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+ | |
| B. | 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| C. | 某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32- | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| A. | C(Fe3+)=0.1mol/L的溶液中:NH4+、I-、SO42-、Cl- | |
| B. | 加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- | |
| C. | 0.1 mol•L-1AgNO3溶液:H+、K+、SO42-、Br- | |
| D. | pH=12的溶液中:K+、Cl-、CH3COO-、CO32- |
| A. | Na2SO4=Na2++SO42- | B. | MgCl2=Mg2++Cl- | ||
| C. | HNO3=H++3NO- | D. | Ba(OH)2=Ba2++2OH- |
| A. | CO32-+H2O?HCO3-+OH-:用热的纯碱溶液清洗油污 | |
| B. | A13++3H2O?AI(OH)3(胶体)+3H+:明矾净水 | |
| C. | SnCl2+H2O?Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液 | |
| D. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+3H+:制备TiO2纳米粉 |
| A. | 2Fe3++SO2+2H2O═SO42-+4H++2Fe2+ | B. | 2Br-+SO42-+4H+═SO2+Br2+2H2O | ||
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | D. | 2Fe3++2I-═2Fe2++I2 |
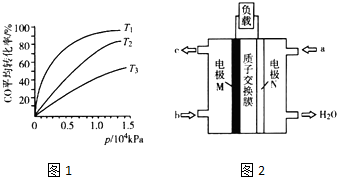
(1)用CH4催化还原NO,可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
由CH4将NO2完全还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数K=-9.7×10-4,NO2-的水解常数K=-8.0×10-10,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kb的代数式表示),此时溶液的温度>25℃(填“>”“<”或“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.不同温度下,CO的平衡转化率与压强的关系如图1所示,图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
(4)化工上还可以利用CH3OH生产CH3OCH3.在体积均为1.0L的恒容密闭容器中发生反应2CH3OH(g)?CH3OCH3(g)+H2O(g).
| 容器换号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH2(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为2CH3OH+3O2═2CO2+4H2O,电池工作时的示意图如图2所示.质子穿过交换膜移向N电极区(填“M”或“N”),负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
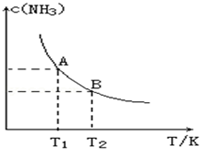 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.