题目内容
14.某化学兴趣小组对下列三组物质进行研究:A.HCl H2SO4 H2CO3 HNO3
B.溶液 水 悬浊液 胶体
C.Na2CO3 NaNO3 AgNO3 Ba(NO3)2
请你帮他们完善下列空白:
| A | B | C | |
| 分类标准 | 含氧酸 | 分散系 | (3)硝酸盐 |
| 不属于该类别的物质 | (1)HCl | (2)水 | Na2CO3 |
分析 A.酸中是否含有氧原子将酸分为:含氧酸与无氧酸;
B.分散系必须是混合物;
C.盐中酸根离子不同属于不同的种类.
解答 解:A.HCl H2SO4 H2CO3 HNO3,都是酸,但是HCl不含氧元素属于无氧酸,其余均属于含氧酸,
B.分散系是混合物,而水是纯净物,不属于混合物;
C.Na2CO3 NaNO3 AgNO3 Ba(NO3)2,四种物质都是盐,但是除了碳酸钠外,其余都是硝酸盐,
故答案为:HCl;水;硝酸盐.
点评 本题考查物质组成、物质分类、概念的理解应用,侧重于化学知识的综合运用,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
4.已知常温下:KSP[Al(OH)3]=6.0×10-18,KSP[Fe(OH)3]=4.0×10-38,某溶液中除H+,OH-外,还有大量的Al3+,Fe3+,Cl-,且这三种离子的物质的量之比为1:1:7,下列有关该溶液判断不正确的是( )
| A. | 向溶液中滴加Na2CO3溶液,立即产生沉淀和气体 | |
| B. | 若C(Cl-)=0.07mol/L,则溶液的PH为2 | |
| C. | 往溶液中加入NaOH溶液,先生成的沉淀呈红褐色 | |
| D. | 往溶液中通入NH3,直至溶液呈中性,此时溶液中C(NH4+)═C(Cl-) |
2.下列实验操作中错误的是( )
| A. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸上 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 称氢氧化钠时,不能直接称量,要放在纸片上称量 |
9.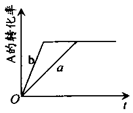 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H>0,A的转化率与时间t关系如图所示,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可能采取的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 移走部分D |
19.在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的是( )
| A. | Mg(OH)2的溶解度最小 | B. | Ca(OH)2的溶解度最小 | ||
| C. | AgCl的溶解度最小 | D. | 相同条件下Ksp越小的溶解度越大 |
6.水体污染加剧水资源短缺,严重危害人体健康.下列关于水污染的描述中不正确的是( )
| A. | 水俣病是由汞等重金属污染水体而造成的 | |
| B. | “赤潮”和“水华”是由水体富营养化而形成的 | |
| C. | 海湾战争期间波斯湾严重的石油泄漏事件是人类历史上一次灾难性的水体污染事件 | |
| D. | 化肥和农药的广泛使用可以促进农产品增产,不会造成水体污染 |
3.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是( )
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 往FeCl3溶液中加入NaOH溶液,并适当加热,可制得Fe(OH)3胶体 | |
| D. | 三种分散系中分散质均属于电解质 |
1.氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)已知:H-H键能为436kJ•mol-1,N≡N键能为945kJ•mol-1,N-H键能为391kJ?mol-1.写出合成氨反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.
(2)恒温下,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
5min内,消耗N2的平均反应速率为0.008mol•L-1•min-1,此条件下该反应的化学平衡常数K=0.1[或0.1(mol•L-1)-2];反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向逆反应方向移动(填“正反应”或“逆反应”).
(1)已知:H-H键能为436kJ•mol-1,N≡N键能为945kJ•mol-1,N-H键能为391kJ?mol-1.写出合成氨反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.
(2)恒温下,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
