题目内容
1.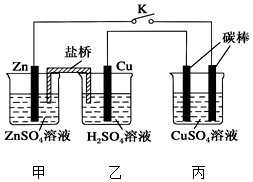 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )| A. | 乙烧杯中铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 丙烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应时盐桥中的阴离子向甲烧杯移动 | |
| D. | 导线中通过电子的物质的量为0.1 mol |
分析 A、Cu活泼性比Zn弱,作正极;
B、与原电池负极相连为阴极,析出铜单质;
C、盐桥中的阴离子向负极区域移动;
D、2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2 ↑+2H2SO4~4e-,据此计算.
解答 解:A、Cu活泼性比Zn弱,作正极,正极上氢离子得电子生成氢气,则其电极反应式为2H++2e-═H2↑,故A正确;
B、烧杯右侧碳棒与原电池负极相连为阴极,阴极上阳离子得电子,即铜离子得电子析出铜单质,故B正确;
C、反应时盐桥中的阴离子向负极区域移动,即向着甲烧杯移动,故C正确;
D、右侧烧杯中反应为2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2 ↑+2H2SO4,加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,故D错误.
故选D.
点评 本题考查了原电池原理和电解池原理的应用,注意根据电子守恒分析,注意把握电极反应式,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列物质中,不属于合金的是( )
| A. | 硬铝 | B. | 黄铜 | C. | 钢铁 | D. | 金箔 |
9.下列有关金属钠的说法正确的是( )
| A. | 钠在空气中燃烧生成氧化钠 | |
| B. | 将钠投入滴有紫色石蕊试液的水中,水溶液变为红色 | |
| C. | 将一小块钠放在CuSO4溶液中发生反应离子方程式:2Na+Cu2+═2Na++Cu | |
| D. | 将4.6gNa投入到95.4g水中,所得溶液中溶质的质量分数大于8.0% |
16.NA为阿伏加德罗常数,下列物质的物质的量最小的是( )
| A. | 标准状况下2.24L O2 | |
| B. | 含NA个氢分子的H2 | |
| C. | 8.5g氨气(氨气的摩尔质量为17g•mol-1) | |
| D. | 含3.01×1022个分子的CH4 |
6.已知:I2+2S2O32═S4O62-+2I-.相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
②该试样中CuCl2•2H2O的质量百分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
②该试样中CuCl2•2H2O的质量百分数为95%.
3.烟气中含有SO2等大量有害物质,烟气除硫的方法有很多,其中石灰石法烟气除硫工艺的主要反应如下
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(s)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成的石灰膏的热化学反应方程式2CaCO3(s)+2SO2(g)+O2(g)+4H2O(l)=2[CaSO4•2H2O](s)+2CO2△H=-681.8kJ/mol
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3个不同的容器中进行反应
A.容器保持恒温恒压 B.容器保持恒温恒容 C.容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是ad
a.3个容器中SO2的平均转化率的大小顺序:aA>aB>aC
b.当A容器内气体的平均摩尔质量不变时说明该反应处于化学平衡状态
c.A,B两个容器达到平衡所用的时间tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据反应Ⅱ来除硫,将一定量的烟气压缩到一个20L的容器中,测得不同温度下容器内SO2的质量如下表:
①在T1温度下,计算20-40min内SO2的反应速率2×10-5mol/(L.min)
②若其它条件都相同,则T1<T2(填“>”或“<”“=”下同):x>0.06
③在T2温度下,若平衡后将容器的容积压缩为10L,则新平衡时SO2的浓度=原平衡时SO2的浓度(填“>”“<”或“=”),理由是该反应的平衡常数表达式为k=$\frac{1}{c(S{O}_{2})}$,温度不变,平衡常数不变,所以浓度相等..
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(s)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成的石灰膏的热化学反应方程式2CaCO3(s)+2SO2(g)+O2(g)+4H2O(l)=2[CaSO4•2H2O](s)+2CO2△H=-681.8kJ/mol
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3个不同的容器中进行反应
A.容器保持恒温恒压 B.容器保持恒温恒容 C.容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是ad
a.3个容器中SO2的平均转化率的大小顺序:aA>aB>aC
b.当A容器内气体的平均摩尔质量不变时说明该反应处于化学平衡状态
c.A,B两个容器达到平衡所用的时间tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据反应Ⅱ来除硫,将一定量的烟气压缩到一个20L的容器中,测得不同温度下容器内SO2的质量如下表:
| 时间/min SO2质量/10-3g 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
②若其它条件都相同,则T1<T2(填“>”或“<”“=”下同):x>0.06
③在T2温度下,若平衡后将容器的容积压缩为10L,则新平衡时SO2的浓度=原平衡时SO2的浓度(填“>”“<”或“=”),理由是该反应的平衡常数表达式为k=$\frac{1}{c(S{O}_{2})}$,温度不变,平衡常数不变,所以浓度相等..
4.已知常温下:KSP[Al(OH)3]=6.0×10-18,KSP[Fe(OH)3]=4.0×10-38,某溶液中除H+,OH-外,还有大量的Al3+,Fe3+,Cl-,且这三种离子的物质的量之比为1:1:7,下列有关该溶液判断不正确的是( )
| A. | 向溶液中滴加Na2CO3溶液,立即产生沉淀和气体 | |
| B. | 若C(Cl-)=0.07mol/L,则溶液的PH为2 | |
| C. | 往溶液中加入NaOH溶液,先生成的沉淀呈红褐色 | |
| D. | 往溶液中通入NH3,直至溶液呈中性,此时溶液中C(NH4+)═C(Cl-) |