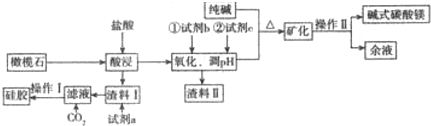
题目内容
2.我国科研人员在兰州合成了镤元素的一种同位素镤239,并测知其原子核内有148个中子.现有A元素的一种同位素,比镤239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第五周期第IA族 | D. | 第二周期第IIA族 |
分析 根据质量数=质子数+中子数,计算出该同位素镤-239的质子数,再计算出A元素的质子数,根据质子数确定其在元素周期表中的物质.用质子数分别减去各周期所含有的元素种数.
解答 解:同位素镤-239的质子数为239-148=91,
所以A元素的质子数为91-54=37.
37-2-8-8-18=1
所以A位于第5周期第IA族.
故选:C.
点评 本题考查物质位构性知识,为高频考点,侧重于学生的分析能力的考查,注意把握原子核的构成特点,为解答该题的关键,把握元素周期律的递变规律,难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
12. 已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0
已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0
(1)SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H1=akJ/mol
SO2Cl2(g)+SCl2(g)?2SOCl2(g)△H2=bkJ/mol
比较a<b(填<、>、=).
(2)反应速率v与反应物浓度的关系可用实验方法测定,v=k•cm(SO2)•cn (Cl2),k为反应速率常数.根据下述实验结果,求m=1n=1.
(3)恒温下,若在容积固定的2L密闭容器中,充入SO2、Cl2各2mol,发生可逆反应:SO2+Cl2?SO2Cl2,达到平衡时,以SO2的浓度改变表示反应速率v正、v逆与时间的关系如图,其中S表示面积,则SO2的平衡浓度为C.
A.1-S(bod) B.S(bod) C.1-S(aob) D.S(aob)
(4)若在催化剂作用下,将n molSO2与n molCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P,起始气体总体积为10L,t min时反应达到平衡,此时气体总体积为8L.
①此温度下,该反应的平衡常数Kp=$\frac{16}{9P}$(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器达平衡状态时,混合物中SO2Cl2的物质的量是0.2n.
(5)SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
已知25℃,Ksp(AgCl)=1.8×10-10,Ksp(Ag2SO4)=1.4×10-5,向SO2Cl2溶于水所得溶液中逐滴加入AgNO3溶液,最先生成的沉淀是Cl-,当第二种离子开始沉淀时,溶液中$\frac{{c}^{2}(C{l}^{-})}{c(S{O}_{4}^{2-})}$=2.3×10-15.
 已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0
已知:有机氯化剂磺酰氯SO2Cl2的制法:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0(1)SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H1=akJ/mol
SO2Cl2(g)+SCl2(g)?2SOCl2(g)△H2=bkJ/mol
比较a<b(填<、>、=).
(2)反应速率v与反应物浓度的关系可用实验方法测定,v=k•cm(SO2)•cn (Cl2),k为反应速率常数.根据下述实验结果,求m=1n=1.
| c(SO2)/mol•L-1 | c(Cl2)/mol•L-1 | v/mol•L-1•S-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 8.0k |
A.1-S(bod) B.S(bod) C.1-S(aob) D.S(aob)
(4)若在催化剂作用下,将n molSO2与n molCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P,起始气体总体积为10L,t min时反应达到平衡,此时气体总体积为8L.
①此温度下,该反应的平衡常数Kp=$\frac{16}{9P}$(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器达平衡状态时,混合物中SO2Cl2的物质的量是0.2n.
(5)SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
已知25℃,Ksp(AgCl)=1.8×10-10,Ksp(Ag2SO4)=1.4×10-5,向SO2Cl2溶于水所得溶液中逐滴加入AgNO3溶液,最先生成的沉淀是Cl-,当第二种离子开始沉淀时,溶液中$\frac{{c}^{2}(C{l}^{-})}{c(S{O}_{4}^{2-})}$=2.3×10-15.
13.图表归纳是学习化学的常用方法,某同学归纳的下表物质与图中对应关系正确的是( )
| 选项 | X | Y | Z |  |
| A | 含氧酸 | 一元强酸 | HclO4 | |
| B | 易溶碱 | 强碱 | NaOH | |
| C | 盐 | 酸式盐 | NaHCO3 | |
| D | 非电解质 | 氧化物 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
12.要配制浓度约为2mol/L NaOH溶液100mL,下列操作正确的是( )
| A. | 称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL | |
| B. | 称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8gNaOH固体,放入100mL烧杯中,将烧杯中加满蒸馏水,同时不断搅拌至固体溶解 | |
| D. | 用100mL量筒量取40ml 5mol/L NaOH溶液,稀释后转移至100ml容量瓶中,洗涤并定容 |
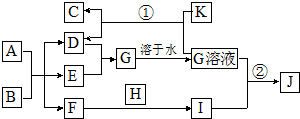 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)