题目内容
14.金属冶炼和处理常涉及氧化还原反应.(1)由下列物质冶炼相应金属时采用电解法的是bd
a.Fe2O3b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2═4CuSO4+2H2O,该反应的还原剂是Cu2S,当1mol O2发生反应时,还原剂所失电子的物质的量为4mol.向CuSO4溶液中加入镁条时有气体生成,产生该气体的离子方程式是Mg+2H+=Mg2++H2↑.
分析 (1)电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的Al2O3)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:冶炼不活泼的金属Hg、Ag用加热分解氧化物的方法制得;
(2)所含元素化合价升高的反应物为还原剂;反应中只有氧气中O元素化合价降低,据此计算转移电子数目;硫酸铜溶液中铜离子水解,溶液呈酸性,CuSO4溶液中加入镁条生成的气体为氢气.
解答 解:(1)a.Fe用热还原法冶炼,故A不选;
b.钠的性质很活泼,用电解熔融氯化钠的方法冶炼,故B选;
c.Cu用热还原法冶炼,故C不选;
d.Al的性质很活泼,用电解其氧化物的方法冶炼,故D选.
故选bd;
(2)Cu2S中Cu、S元素化合价都生成升高,故Cu2S是还原剂;反应中只有氧气中O元素化合价降低,故1mol氧气反应转移电子为1mol×4=4mol;硫酸铜溶液中铜离子水解,溶液呈酸性,CuSO4溶液中加入镁条生成的气体为氢气,其反应的离子方程式Mg+2H+=Mg2++H2↑.
故答案为:Cu2S;4;Mg+2H+=Mg2++H2↑.
点评 本题考查了金属的冶炼方法、氧化还原反应、离子方程式的书写等知识点,根据金属的活泼性确定冶炼方法、氧化还原反应原理来分析解答,难度不大.

练习册系列答案
相关题目
5.已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量;②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量.下列叙述中正确的是( )
| A. | 氢气和氯气反应生成氯化氢气体是放热反应,所以不需要条件就能自发进行 | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应吸收183 kJ的热量 | |
| C. | 氢气和氯气反应生成2 mol氯化氢气体,反应放出183 kJ的热量 | |
| D. | 氢气和氯气反应生成1 mol氯化氢气体,反应放出183 kJ的热量 |
2.我国科研人员在兰州合成了镤元素的一种同位素镤239,并测知其原子核内有148个中子.现有A元素的一种同位素,比镤239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第五周期第IA族 | D. | 第二周期第IIA族 |
9.下列化学用语表示正确的是( )
| A. | 铁原子的电子排布式:[Ar]3d64s2 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 氢氧化钠的电子式: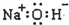 | D. | F的原子结构示意图: |
3.下列离子反应方程式正确的是( )
| A. | 在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O | |
| B. | SO2气体通入Fe2(SO4)3溶液中:SO2+2H2O+2Fe3+=2Fe2++4H++SO42- | |
| C. | 用白醋除铁锈:Fe2O3•xH2O+6H+=(3+x)H2O+2Fe3+ | |
| D. | 硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3•H2O+H2O |
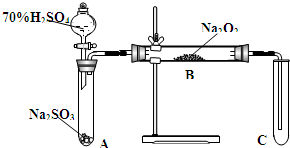 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
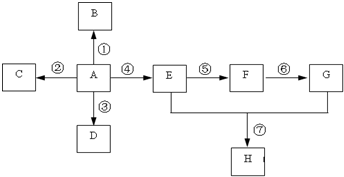 已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30.A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去).其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取.D为烃,不能使酸性高锰酸钾溶液褪色.E、G为生活中常见的有机物,且E有特殊香味,H有香味.
已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30.A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去).其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取.D为烃,不能使酸性高锰酸钾溶液褪色.E、G为生活中常见的有机物,且E有特殊香味,H有香味.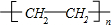 ;
;