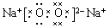题目内容
17.写出下列实验的化学方程式或电离方程式:(1)用自来水配制碘化钾溶液时,溶液呈黄色;2KI+Cl2=I2 +2KCl.
(2)碳酸氢钠溶于水;NaHCO3=Na++HCO3-.
(3)铁丝在氯气中燃烧产生黄棕色的烟;3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(4)氟单质通人氯化钠溶液中,有气体逸出;2F2+2H2O=4HF+O2↑.
分析 (1)氯水中氯气与KI发生氧化还原反应生成碘和KCl;
(2)强电解质能完全电离;
(3)铁丝在氯气中燃烧产生氯化铁;
(4)氟单质通人氯化钠溶液中,会和水之间反应产生氧气.
解答 解:(1)氯水中氯气与KI发生氧化还原反应生成碘和KCl,溶液变黄,反应为2KI+Cl2=I2 +2KCl,故答案为:2KI+Cl2=I2 +2KCl;
(2)碳酸氢钠属于盐,能完全电离,即:NaHCO3=Na++HCO3-,故答案为:NaHCO3=Na++HCO3-;
(3)铁丝在氯气中燃烧出现黄棕色的烟,即产生氯化铁,反应为:3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故答案为:3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(4)氟单质通人氯化钠溶液中,会和水之间反应产生氧气,即2F2+2H2O=4HF+O2↑,故答案为:2F2+2H2O=4HF+O2↑.
点评 本题考查学生方程式的书写知识,注意物质的性质是关键,难度不大.

练习册系列答案
相关题目
7. 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
(1)已知:①2CH3OH(l)+3O2(g)﹦2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量之比1:1进行催化反应,其原子利用率达100%,合成的物质可能是cd
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
①下列对该反应的有关说法不正确的是a
a.当v(CO)=2v(H2)时,该反应处于平衡状态
b.恒温恒压下,容器内气体的密度不再改变时,表明反应达到平衡状态
c.在原平衡体系中充入一定量的氦气,平衡可能发生移动
d.恒温恒压下,改变反应物的投入量,△H的值不发生变化
e.温度一定时,缩小容器的体积,平衡将向右移动,c(CO)将变大
②若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列判断正确的是ac.
a.c3>2c1=2c2
b.Q1+Q2=90.8 Q3=2Q1
c.K1=K2=K3
d.a2+a3<100%
(4)CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),一定温度下,在1L密闭容器中充入3molH2和3molCO进行反应,若用po表示该体系开始时的总压强,p表示平衡时的总压强,则平衡时CO的转化率为$\frac{3(p-{p}_{0})}{2{p}_{0}}$×100%(用po、p的式子表示)
(5)如图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+.
 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.(1)已知:①2CH3OH(l)+3O2(g)﹦2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量之比1:1进行催化反应,其原子利用率达100%,合成的物质可能是cd
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
①下列对该反应的有关说法不正确的是a
a.当v(CO)=2v(H2)时,该反应处于平衡状态
b.恒温恒压下,容器内气体的密度不再改变时,表明反应达到平衡状态
c.在原平衡体系中充入一定量的氦气,平衡可能发生移动
d.恒温恒压下,改变反应物的投入量,△H的值不发生变化
e.温度一定时,缩小容器的体积,平衡将向右移动,c(CO)将变大
②若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH平衡时浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
a.c3>2c1=2c2
b.Q1+Q2=90.8 Q3=2Q1
c.K1=K2=K3
d.a2+a3<100%
(4)CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),一定温度下,在1L密闭容器中充入3molH2和3molCO进行反应,若用po表示该体系开始时的总压强,p表示平衡时的总压强,则平衡时CO的转化率为$\frac{3(p-{p}_{0})}{2{p}_{0}}$×100%(用po、p的式子表示)
(5)如图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+.
5.已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量;②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量.下列叙述中正确的是( )
| A. | 氢气和氯气反应生成氯化氢气体是放热反应,所以不需要条件就能自发进行 | |
| B. | 氢气和氯气反应生成2 mol氯化氢气体,反应吸收183 kJ的热量 | |
| C. | 氢气和氯气反应生成2 mol氯化氢气体,反应放出183 kJ的热量 | |
| D. | 氢气和氯气反应生成1 mol氯化氢气体,反应放出183 kJ的热量 |
12.已知:2Na[Al(OH)4]+CO2+3H2O=2Al(OH)3↓+Na2CO3.向含2mol NaOH、1mol Ba(OH)2、2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系不正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 6 | 4 | 3 | 2 |
| n(沉淀)(mol) | 2 | 3 | 2 | 1 |
| A. | A | B. | B | C. | C | D. | D |
2.我国科研人员在兰州合成了镤元素的一种同位素镤239,并测知其原子核内有148个中子.现有A元素的一种同位素,比镤239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第五周期第IA族 | D. | 第二周期第IIA族 |
9.下列化学用语表示正确的是( )
| A. | 铁原子的电子排布式:[Ar]3d64s2 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 氢氧化钠的电子式: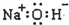 | D. | F的原子结构示意图: |
7.胶体区别于其它分散系的特征是( )
| A. | 胶体粒子能够发生布朗运动 | B. | 胶体粒子带电荷 | ||
| C. | 胶体粒子直径在1-100nm之间 | D. | 胶体粒子不能穿过半透膜 |