题目内容
7.以橄榄石(主要成分是Mg9FeSi5O20)等为原料生产硅胶、碱式碳酸镁[Mg2(OH)2CO3]的部分工艺流程如图所示: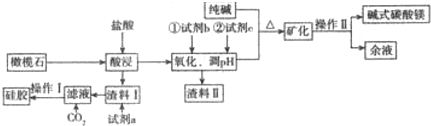
(1)Mg9FeSi5O20中铁元素的化合价为+2,为提高镁的浸出率,可采用的两种主要措施是橄榄石粉碎、不断搅拌混合物渣料II的成分是Fe(OH)3.
(2)若试剂b是氯碱工业中的某种气体产物,写出加入b后反应的离子方程式2Fe2++Cl2=2Cl-+2Fe3+.试剂c的用途是调节溶液的pH,比较恰当的物质是Mg(OH)2或MgO或MgCO3(写化学式,后同),余液中溶质的主要成分是NaCl.
(3)操作I的名称是过滤、洗涤后再干燥脱水,写出生成碱式碳酸镁(同时有气体生成)的离子方程式2Mg2++2CO32-+H2O=Mg2(OH)2CO3↓+CO2↑.
分析 橄榄石(主要成分是Mg9FeSi5O20)加入HCl酸浸,过滤得滤液中含有氯化镁和氯化亚铁,试剂b是氯碱工业中的某种气体产物应为氯气,即在滤液中通入氯气,将氯化亚铁氧化成氯化铁,再用Mg(OH)2或 MgO 或MgCO3调节溶液的PH值,使铁离子生成氢氧化铁沉淀,所以试剂c应为Mg(OH)2或 MgO 或MgCO3,过滤得渣料Ⅱ为Fe(OH)3,在氯化镁滤液中加纯碱,再加热可得碱式碳酸镁,然后过滤得到碱式碳酸镁,同时得到余液应为NaCl溶液,橄榄石(主要成分是Mg9FeSi5O20)加入HCl酸浸,得到的渣料Ⅰ应为含有杂质的二氧化硅等,用氢氧化钠溶液溶解、过滤可得硅酸钠溶液,所以试剂a为氢氧化钠溶液,过滤得到硅酸钠溶液,向其中通入二氧化碳得硅酸沉淀,经过滤、洗涤后再干燥脱水可得硅胶,所以操作Ⅰ为过滤、洗涤后再干燥脱水,据此答题.
解答 解:橄榄石(主要成分是Mg9FeSi5O20)加入HCl酸浸,过滤得滤液中含有氯化镁和氯化亚铁,试剂b是氯碱工业中的某种气体产物应为氯气,即在滤液中通入氯气,将氯化亚铁氧化成氯化铁,再用Mg(OH)2或 MgO 或MgCO3调节溶液的PH值,使铁离子生成氢氧化铁沉淀,所以试剂c应为Mg(OH)2或 MgO 或MgCO3,过滤得渣料Ⅱ为Fe(OH)3,在氯化镁滤液中加纯碱,再加热可得碱式碳酸镁,然后过滤得到碱式碳酸镁,同时得到余液应为NaCl溶液,橄榄石(主要成分是Mg9FeSi5O20)加入HCl酸浸,得到的渣料Ⅰ应为含有杂质的二氧化硅等,用氢氧化钠溶液溶解、过滤可得硅酸钠溶液,所以试剂a为氢氧化钠溶液,过滤得到硅酸钠溶液,向其中通入二氧化碳得硅酸沉淀,经过滤、洗涤后再干燥脱水可得硅胶,所以操作Ⅰ为过滤、洗涤后再干燥脱水,
(1)根据化合价代数和为0可知,Mg9FeSi5O20中铁元素的化合价为+2价,为提高镁的浸出率,可将橄榄石粉碎、不断搅拌混合物,根据上面的分析可知,渣料II的成分是Fe(OH)3,
故答案为:+2;橄榄石粉碎、不断搅拌混合物;Fe(OH)3;
(2)根据上面的分析可知,b为氯气,加入b后反应的离子方程式为2 Fe2++Cl2=2 Cl-+2 Fe3+,试剂c为Mg(OH)2或 MgO 或MgCO3,余液中溶质的主要成分是 NaCl,
故答案为:2 Fe2++Cl2=2 Cl-+2 Fe3+;Mg(OH)2或 MgO 或MgCO3;NaCl;
(3)根据上面的分析可知,操作I是过滤、洗涤后再干燥脱水,生成碱式碳酸镁(同时有气体生成)的离子方程式为2Mg2++2CO32-+H2O=Mg2(OH)2 CO3↓+CO2↑,
故答案为:过滤、洗涤后再干燥脱水;2Mg2++2CO32-+H2O=Mg2(OH)2 CO3↓+CO2↑.
点评 本题考查物质制备,为高频考点,侧重考查学生分析、判断、计算及知识综合运用能力,涉及化学方程式的计算、反应速率影响因素、物质分离和提纯、离子方程式的书写等知识点,明确基本原理、元素化合物性质、物质分离和提纯方法是解本题关键,题目难度不大.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | 0.2 mol | B. | 0.4 mol | C. | 0.8 mol | D. | 0.9 mol |
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型  | ||
| C. | 甲基的电子式: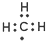 | D. | 硬脂酸的化学式:C17H33COOH |
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第五周期第IA族 | D. | 第二周期第IIA族 |
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
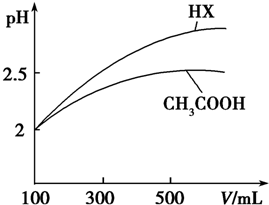
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+c(HCO3-)+c(H+);②c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-).
| A. | O2 | B. | Na2O | C. | NaClO | D. | FeSO |