题目内容
10.下列电子式正确的是( )| A. | H2O2 | B. | 羟基: | C. | 甲基: | D. | NH4Cl: |
分析 A、双氧水为共价化合物;
B、羟基不带电荷;
C、甲基中的C原子有一个单电子;
D、氯化铵中的铵根离子为阳离子原子团,应表示出成键情况.
解答 解:A、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故A错误;
,故A错误;
B、羟基不带电荷,结构中存在一个氧氢共用电子对,羟基的电子式为: ,故B错误;
,故B错误;
C、甲基中的C原子有一个单电子,其余三个电子和三个H原子形成3对共用电子对,故电子式为 ,故C正确;
,故C正确;
D、氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故D错误.
,故D错误.
故选C.
点评 本题考查常用化学用语,准确判断物质所含化学键类型、熟练掌握电子式书写方法即可解答,题目难度不大.

练习册系列答案
相关题目
20.下列实验中,能证明苯酚的酸性极弱的是( )
| A. | 跟氢氧化钠溶液反应生成苯酚钠 | |
| B. | 跟FeCl3溶液作用显紫色 | |
| C. | 常温下苯酚在水中溶解度不大 | |
| D. | 二氧化碳气体通入苯酚钠溶液能生成苯酚 |
1.已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A. | 金刚石与石墨互为同位素 | |
| B. | 石墨不如金刚石稳定 | |
| C. | 金刚石比石墨能量低 | |
| D. | 等质量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
5.用一定量的SO2和O2在容积固定的2L密闭容器内发生反应:2SO2+O2?2SO3,如果v(SO2)=0.05mol/(L•min),则2min后SO3的物质的量为( )
| A. | 0.2 mol | B. | 0.1 mol | C. | 0.2 mol/L | D. | 0.1 mol/L |
15.用下列装置图进行相应的实验,其中正确的是( )
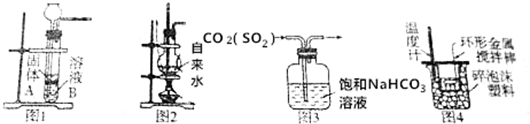

| A. | 用图1装置,若A为石灰石,B为稀硫酸,则可制取二氧化碳 | |
| B. | 用图2装置,若加上冷凝装置,可制取蒸馏水 | |
| C. | 用图3装置,可除去二氧化碳中的杂质二氧化硫 | |
| D. | 用图4装置,可测定中和热 |
2.常温下,下列各组离子在指定的溶液中能够大量共存的是( )
| 选项 | 溶液 | 离子组 |
| A | 滴加NaOH溶液可产生有刺激性气味的气体的溶液中 | K+、S2-、SO${\;}_{4}^{2-}$、NO3- |
| B | 有HCO${\;}_{3}^{-}$存在的溶液中 | Na+ K+、Cl-、AlO${\;}_{2}^{-}$ |
| C | pH=1的溶液中 | F-、Ca+、NO${\;}_{3}^{-}$、K+ |
| D | 能使紫色石蕊试液变红的溶液中 | Fe2+、MnO4-、NO${\;}_{3}^{-}$、SO42- |
| A. | A | B. | B | C. | C | D. | D |
15.短周期主族元素X、Y、Z、W原子序数依次增大,X最外层电子数是次外层2倍,Y是非金属性最强的元素,Z原子半径在同周期元素中最大,W可与Z形成离子化合物Z2W.下列说法正确的是( )
| A. | 四种元素在自然界均不能以游离态存在 | |
| B. | X、Z、W均可形成两种常见氧化物 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |

 、C
、C .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. B.
B.
 D.
D.