题目内容
18.常温下,浓度均为0.01mol/L(NH4)2SO4和NaHSO4两种溶液,都呈酸性:①其中呈酸性的原因是由水解引起的是(NH4)2SO4[填“(NH4)2SO4”或“NaHSO4”]
②写出(NH4)2SO4呈酸性的原因的离子方程式NH4++H2O?NH3•H2O+H+;
③常温下,pH=3的NaHSO4溶液的物质的量浓度c=10-3mol/L.
分析 ①含有弱离子的盐可以发生水解,强酸强碱盐不会发生水解;
②(NH4)2SO4是强酸弱碱盐,NH4+在溶液中水解,根据水解原理书写方程式;
③NaHSO4溶液是强电解质,能完全电离出氢离子、硫酸根离子和钠离子,据pH=-lgc(H+)来计算.
解答 解:①含有弱离子的盐可以发生水解,强酸强碱盐不会发生水解,(NH4)2SO4是强酸弱碱盐,NH4+在溶液中水解导致溶液显酸性,
NaHSO4两种溶液不水解,是因为电离出氢离子显示酸性,故答案为:(NH4)2SO4;
②(NH4)2SO4是强酸弱碱盐,NH4+在溶液中水解导致溶液显酸性,离子方程式:NH4++H2O?NH3•H2O+H+;故答案为:NH4++H2O?NH3•H2O+H+;
③常温下,pH=3的NaHSO4溶液能完全电离出等浓度的氢离子、硫酸根离子和钠离子,pH=-lgc(H+)=3,所以c(H+)=10-3mol/L,故答案为:10-3.
点评 本题考查了盐溶液显酸碱性的原因以及盐类水解的离子方程式的书写,难度不大,注意水解的原理是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.常用一些图案标示危险化学品,化学物质与其图案标识相符的是( )
| A. |  氮气 | B. |  铜片 | C. |  浓盐酸 | D. |  浓硝酸 |
9.①丙烷,②正丁烷,③正戊烷,按沸点的高低顺序排列正确的是( )
| A. | ①>②>③ | B. | ③>②>① | C. | ③>①>② | D. | ②>①>③ |
13.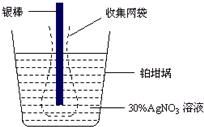 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )| A. | 电量计中的银棒应与电源的正极相连,铂棒上发生的电极反应式为:2H++NO3-+e-=NO2↑+H2O | |
| B. | 已知每摩尔电子的电量为96 500 C,若反应进行10分钟,称量电解前后铂坩埚的质量变化值为108.0 mg,则电解过程中的平均电流约为9.65A | |
| C. | 若要测定电解精炼铜时通过的电量,可将银电量计中的银棒与待测电解池的精铜电极相连 | |
| D. | 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏低 |
3.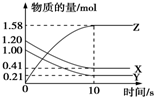 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10 s时,平均反应速率:v(X)=v(Y)=0.039 5 mol•L-1•s-1 | |
| C. | 10 s后,该反应停止进行 | |
| D. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) |
10.下列电子式正确的是( )
| A. | H2O2 | B. | 羟基: | C. | 甲基: | D. | NH4Cl: |
7.下列说法不正确的是( )
| A. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 油脂皂化反应得到高级脂肪酸与甘油 | |
| C. | 用甘氨酸(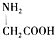 )和丙氨酸( )和丙氨酸(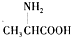 )的混合物在一定条件下可形成四种链状二肽 )的混合物在一定条件下可形成四种链状二肽 | |
| D. | 实验证实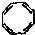 可使溴的CCl4溶液褪色,说明该分子中够存在碳碳双键 可使溴的CCl4溶液褪色,说明该分子中够存在碳碳双键 |
3.下列有关金属的工业制法中,不正确的是( )
| A. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| B. | 制镁:用海水为原料,经一系列过程制得氯化镁固体,电解熔融的氯化镁得镁 | |
| C. | 制铁:以铁矿石为原料,CO还原得铁 | |
| D. | 制铝:从铝土矿中获得氧化铝,提纯后电解熔融的氧化铝得到铝 |