题目内容
利用电解原理,在铁皮表面镀一层锌的有关叙述正确的是( )
| A、铁为负极,锌为正极 |
| B、铁为阳极,锌为阴极 |
| C、用可溶性铁盐作电解液 |
| D、锌元素既被氧化又被还原 |
考点:电解原理
专题:电化学专题
分析:利用电解原理,在铁皮表面镀一层锌,那么金属锌作电解池的阳极,铁作阴极,阳极锌放电生成锌离子进入溶液,溶液中的锌离子在阴极放电,从而在铁上镀上锌,据此解答即可.
解答:
解:在铁皮表面镀一层锌,那么金属锌作电解池的阳极,发生氧化反应,铁作阴极,阳极锌放电生成锌离子进入溶液,溶液中的锌离子在阴极放电,被还原,从而在铁上镀上锌,故锌既被氧化,又被还原,故选D.
点评:本题主要考查的是电解原理的应用,分清电极反应是解决本题的关键,难度不大.

练习册系列答案
相关题目
右图为元素周期表短周期的一部分.关A~F六种元素的叙述正确的是( )
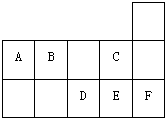

| A、A、B、D、E四种元素所形成的最高价含氧酸中D酸性最强 |
| B、形成的简单阴离子半径:C>B>D>E |
| C、D、E、F形成的单质都是双原子分子 |
| D、A与E形成的分子是一种常见有机溶剂 |
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A、25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
| B、将0.1 mol?L-1的醋酸加水不断稀释,所有离子浓度均减小 |
| C、少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| D、少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO |
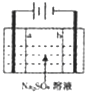 近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )
近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )| A、阴极反应式4OH--4e-=2H2O+O2↑ |
| B、阴极得到NaOH,阳极得到H2SO4 |
| C、每生产1molH2SO4,同时得到2mol NaOH |
| D、此反应实质就是电解水 |
 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A、△H>0 a+b>c |
| B、△H<0 a+b<c |
| C、△H<0 a+b>c |
| D、△H>0 a+b<c |

